- Chi tiết
-
Được đăng: 15 Tháng 11 2017
Chúng ta đều nhận thức được sự liên kết không thể tách rời giữa thực hành y khoa và những tiến bộ khoa học. Nếu khoảng thời gian giữa những khám phá sinh học và ứng dụng của chúng trong y khoa thường phải rất dài, khoảng cách này đôi khi có thể được rút ngắn đáng kể qua các dự án nghiên cứu gọi là "tịnh tiến", từ khoa học cơ bản đến giường bệnh. Chúng tôi đề nghị vào đây để xem qua nhữngkhám phá sinh học chính được trao giải Nobel và các ứng dụng của chúng trong lĩnh vực hô hấp.
TELOMERE VÀ TELOMERASE: TỪ SỰ LÃO HÓA TẾ BÀO ĐẾN CÁC BỆNH HÔ HẤP MẠN TÍNH
Sự suy thoái tế bào là một cơ chế sinh học phổ biến của sự lão hóa của tế bào được biết đến trong hơn một nửa thế kỷ nay.1 Theo các kiến thức mới nhất, vai trò của telomere (tận cùng của nhiễm sắc thể mà rút ngắn với mỗi kỳ phân chia tế bào) và telomerase (enzyme giúp tái cấu trúc các telomere) có tầm quan trọng cơ bản, bằng chứng là giải Nobel 2009 trao tặng cho Elizabeth Blackburn, Carol Greider và Jack Szostak.2
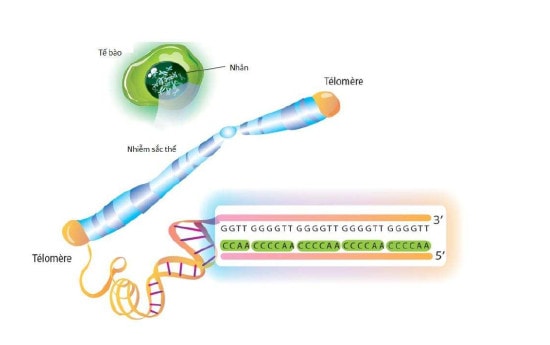
Hình 1. Cấu trúc các telomere.
Telomere là các cấu trúc nucleotide đóng vai trò như là cái mũ ở hai đầu của nhiễm sắc thể cho phép sao chép hoàn toàn các vật liệu di truyền (Hình 1). Sự hiện diện của chúng rất cần thiết để giữ cấu trúc tuyến tính của nhiễm sắc thể, trong khi nếu không có các telomere này sẽ dễ dẫn đến sự hình thành các nhiễm sắc thể tròn hoặc sáp nhập của hai nhiễm sắc thể riêng biệt.3 Tuy nhiên, "mũ telomere" này lại ngăn cản hoạt động của DNA polymerase, do đó giải thích vì sao có sự rút ngắn của nhiễm sắc thể sau mỗi lần phân bào (Hình 2). Telomerase là enzyme có khả năng ngăn chặn sự rút ngắn dần của nhiễm sắc thể theo mỗi lần phân bào bằng cách bổ sung các chuỗi trình tự mà không thể được nhân đôi bởi DNA polymerase3 (Hình 3).
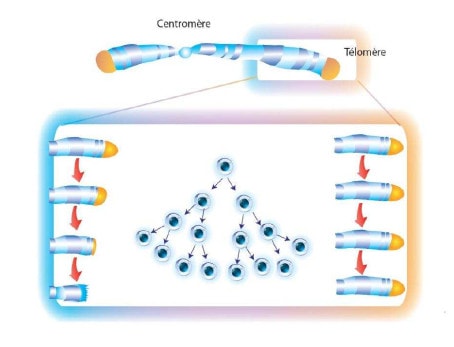
Hình 2. Độ dài của các telomere sau mỗi kỳ phân bào.
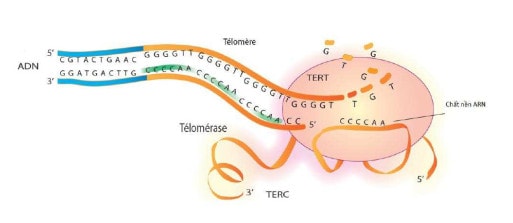
Hình 3. Các cấu trúc và chức năng của telomere.
Telomerase được hình thành từ sự kết hợp của một enzyme xúc tác, telomerase transcriptase reverse (TERT), và đoạn RNA gọi là telomerase RNA component (TERC), đóng vai trò như là khuôn phiên mã ngược (TERT) cho quá trình tổng hợp lại từ đầu của đoạn DNA phụ bị thiếu (Hình 3).
Telomere và bệnh phổi tắc nghẽn mạn tính (COPD) Trên nhiều khía cạnh, COPD tương tự như một hiện tượng lão hóa bị thúc đẩy nhanh của mô phổi.4-6 COPD có thể là kết quả của hai tình huống bất lợi: (a) một cơ địa di truyền định sẵn dễ dẫn đến lão hóa phổi bị thúc đẩy nhanh và (b) áp lực môi trường (ví dụ, khói thuốc lá).4-6 Nhiều lập luận ủng hộ giả thuyết này đặc biệt thể hiện mối liên hệ giữa sự rút ngắn telomere và sự khởi đầu của COPD ở người hút thuốc.7-9 Đặc biệt, sự rút ngắn của telomere có thể đo được thông qua các nhiễm sắc thể trích từ các bạch cầu trong máu ngoại vi.10 Tốc độ rút ngắn của telomere tỷ lệ thuận trực tiếp với tốc độ suy giảm chức năng phổi10 khi mà telomere ngắn có liên quan với sự suy giảm chất lượng cuộc sống, với nguy cơ cao của các đợt kịch phát và nguy cơ tử vong cao ở những bệnh nhân COPD.11
Telomere và bệnh xơ phổi
Nghiên cứu đầu tiên cho thấy sự tồn tại của một đột biến của telomerase ở thể gia đình của xơ phổi vô căn (IPF) cách đây đúng 10 năm12 Các nghiên cứu khác sau đó đã xác nhận sự tồn tại của đột biến ở gen mã hóa TERT, enzyme cho phép kéo dài telomere từ TERC, thành phần RNA của telomerase.13 Hơn nữa, sự rút ngắn telomere cũng có thể thấy ở những bệnh nhân xơ phổi vô căn không có đột biến gen TERT.14 Ngày nay chúng ta hiểu rõ hơn các cơ chế giải thích bằng cách nào mà chỉ đơn giản là sự ăn mòn các đầu tận của nhiễm sắc thể của tế bào mà có thể dẫn đến sự lão hóa sinh lý của tế bào và do đó có sự gia tăng bệnh lý từ hiện tượng này dẫn đến COPD và IPF.15-17
TỰ THỰC BÀO: TỪ HIỆN TƯỢNG TỰ THỰC BÀO ĐẾN CÁC BỆNH LÝ ĐƯỜNG HÔ HẤP
Tự thực bào (autophagy), có thể được dịch theo nghĩa văn chương là ăn (φαγεῖν, phagein) chính mình (αὐτό, auto), phản ánh một khả năng đặc biệt của các tế bào nhân chuẩn (eukaryotic)
là tự loại bỏ một số thành phần của chính mình bởi quá trình tiêu hóa enzyme. Hiện tượng này, vẫn thường bị đánh đồng với thuật ngữ “tự hủy” (auto-cannibalism).18 đã được biết đến trong hơn 50 năm nay. Trên thực tế, thuật ngữ này đã được giới thiệu vào giữa thế kỷ trước bởi một bác sĩ sinh học của Bỉ, Chistian de Duve, với mô tả ban đầu của ông về các cơ chế suy thoái của một vài bào quan nhất định trong tế bào bằng các lysosome,19 mà khám phá này đã cho phép ông chia giải Nobel với Albert Claude và George Emile Palade vào năm 1974.20 Tầm quan trọng của những hiện tượng tự hủy “bảo toàn” (autodestruction salvatrice) được một lần nữa nhấn mạnh bằng giải Nobel vào năm 2016 dành cho nhà nghiên cứu Nhật Bản Yoshinori Ohsumi với mô tả của ông về cơ chế tự thực bào.21, 22
Ba hình thức sinh học của tự thực bào
Trên thực tế chúng ta có không chỉ một mà là ba hình thức sinh học của tự thực bào:23 (1) macro-autophagy, (2) micro-autophagy (hay microphagy) và (3) tự thực bào qua trung gian chaperon (CMA) (Hình 4).
Macro-autophagy vẫn thường được gọi là autophagy (tự thực bào), là hình thức được biết đến lâu đời nhất (đã được mô tả bởi Christian de Duve trong thập niên 60)19và đặc trưng nhất. Bước đầu tiên của quá trình này liên quan đến sự hình thành không bào bao bọc bởi một lớp màng kép, được gọi là thể tự thực bào (auto-phagosome), cô lập một cách không chọn lọc các đại phân tử (kết hạt protein) và các bào quan (ty thể, peroxisome) (Hình 4 & 5). Thể tự thực bào sau đó hòa lẫn với các lysosome để tạo thành phago-lysosome trong đó các thành phần đại phân tử sẽ bị suy thoái bởi quá trình thủy phân enzyme (Hình 5). Macro autophagy trực tiếp tham gia vào việc bảo vệ chống lại các khối u và bảo vệ chống lại sự xâm nhập của các tác nhân gây bệnh (virus và vi khuẩn) và đóng vai trò thiết yếu trong sự phát triển phôi thai và sự biệt hóa mô.
Micro(-auto)phagy diễn ra trực tiếp tại lysosome, là sự bắt giữ các thành phần nhỏ của tế bào chất nhờ sự lõm vào của màng lysosome (Hình 4). Micro(-auto)phagy tham gia vào sự thoái biến của các protein đã tồn tại lâu dài.
Tự thực bào qua trung gian chaperon (CMA) được đặc trưng bởi sự chuyển vị của protein cần phân huỷ đi trực tiếp từ chất nguyên sinh vào bên trong lysosome. Vì là vận chuyển xuyên màng nên chỉ có các protein hòa tan mới được đưa vào lysosome để phân hủy. Do đó các bào quan trong tế bào (ty thể, peroxisome) không bị thực bào qua cơ chế trung gian chaperon. Không giống như hai hình thức còn lại của tự thực bào (macro- và micro-autophagy), sự tiêu hóa protein của cơ chế tự thực bào qua trung gian chaperon được thực hiện một cách có chọn lọc, cho phép loại bỏ đặc hiệu các protein có cấu trúc và chức năng bị biến chất bởi các chất độc tế bào như stress oxy hóa. Cơ chế này cũng cho phép bảo tồn các protein còn nguyên vẹn cần thiết cho chức năng của tế bào. Đây là hình thức tự thực bào tồn tại độc quyền ở động vật có vú trong khi micro- và macro-autophagy tồn tại trong hầu hết các sinh vật nhân chuẩn.24
Dù loại tự thực bào nào, người ta cũng có thể xem đây như là một cơ chế kiểm soát chất lượng mà các tế bào thực hiện trên các yếu tố cấu thành của chính tế bào đó, bằng cách loại bỏ các thành phần biến chất và bảo tồn các thành phần còn nguyên vẹn, nhằm tối ưu hóa các chức năng cần thiết cho sự sống còn của tế bào. Hệ quả của việc này là nguy cơ dẫn đến sự chết tế bào trong các tình huống bệnh lý đặc trưng bởi sự suy giảm về chất lượng hay số lượng của cơ chế tự thực bào.
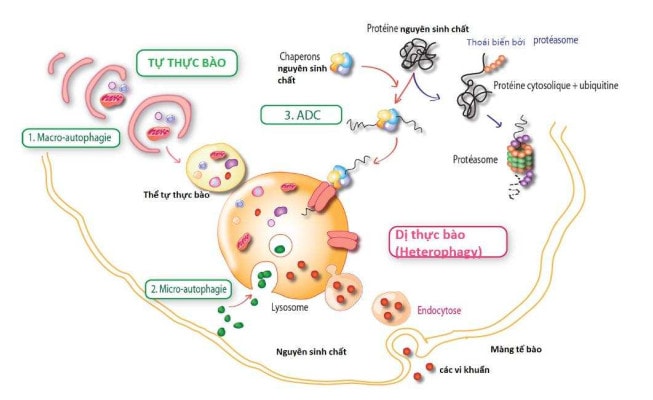
Hình 4. Ba hình thức của thực bào: (1) macro-autophagy, (2) micro- autophagy và (3) tự thực bào qua trung gian chaperon.
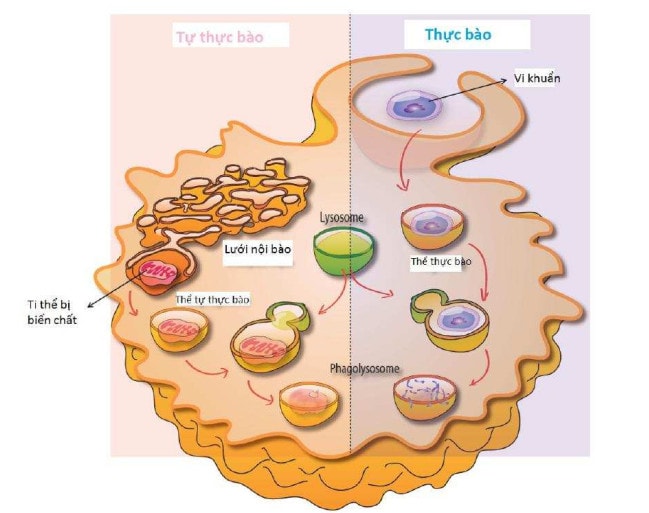
Hình 5. Vai trò của lysosome trong thực bào và tự thực bào.
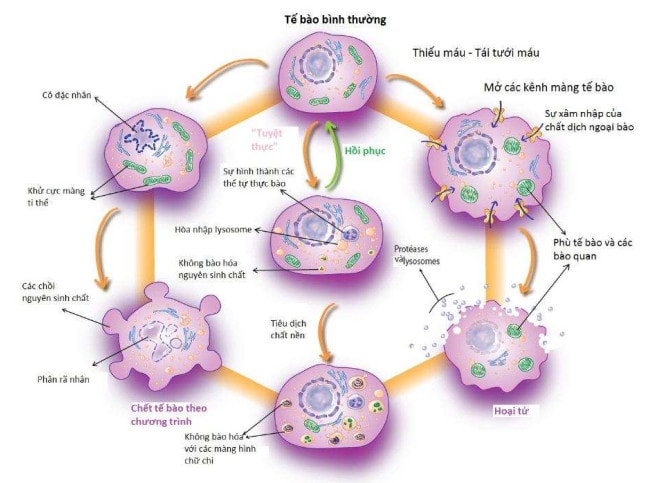
Hình 6. Ba hình thức chết tế bào: (1) chết tế bào theo chương trình apoptosis, (2) chết tự thực bào, (3) hoại tử.
Tự thực bào (autophagy) và chết tế bào theo chương trình (apoptosis)
Sự tự thực bào (autophagy) và sự chết tế bào theo chương trình (apoptosis) là hai hiện tượng khác nhau, thường là bổ sung cho nhau nhưng đôi khi đối kháng nhau trong việc xác định việc chết và / hoặc sự tồn tại của tế bào nhân chuẩn (Hình 6).25 Sự chết tế bào theo chương trình (apoptosis) chủ yếu là một hiện tượng chết tế bào trong khi sự tự thực bào (autophagy) chủ yếu là một quá trình bảo vệ tế bào, mặc dù nó cũng có thể, trong những hoàn cảnh cụ thể, thúc đẩy sự chết tế bào bằng một quá trình được biết đến với cái tên là "cái chết tự thực bào" (Hình 6).25 Có sự truyền tín hiệu tế bào phức tạp để điều hòa sự “đối thoại” ở mức độ phân tử giữa cơ chế tự thực bào và chết tế bào theo chương trình và kiểm soát số phận của tế bào.26 Cũng như cơ chế chết tế bào theo chương trình (apoptosis) được quy định bởi một gia đình gen
cụ thể, các gen CED (Cell Death), cơ chế tự thực bào (autophagy) cũng được điều khiển bởi một gia đình gen đặc biệt, gọi là ATG (autophagy related genes) tham gia vào sự cấu thành của các thể tự thực bào.27 Các protein chống lại cơ chế chết tế bào (apoptosis) của gia đình Bcl-2 chống chống lại sự tự thực bào (autophagy) bằng cách ức chế protein Beclin 1 (Atg6) cần thiết cho sự hình thành của các thể tự thực bào.28 Ngược lại, sự tự thực bào ức chế một cách gián tiếp sự chết tế bào theo chương trình bởi hiệu ứng bảo vệ tế bào của nó.26 Thật vậy, sự tự thực bào, bằng cách cho phép các tế bào loại bỏ các thành phần không cần thiết và có khả năng trở thành chất kích ứng của sự chết tế bào theo chương trình, được xem như là một hiện tượng bảo vệ tế bào nhằm ngăn ngừa sự khởi đầu của quá trình chết tế bào theo chương trình. Hơn nữa, sự tự thực bào cung cấp năng lượng cần thiết để truyền các tín hiệu cần thiết cho thực bào (từ đó loại bỏ) của các tế bào chết theo chương trình.29 Sự khiếm khuyết của việc loại bỏ các tế bào chết theo chương trình dẫn đến sự tích tụ đại thực bào và thúc đẩy sự hình thành và / hoặc sự tồn lưu các ổ mô viêm thứ phát từ việc phóng thích các chất của các tế bào chết theo chương trình trong khu vực ngoại bào (hoại tử thứ phát).
Vai trò miễn dịch của tự thực bào
Vai trò của tự thực bào trong miễn dịch, từ nay đã được chấp nhận,30 dựa trên cơ sở tập hợp các bằng chứng thực nghiệm. Hiện tượng tự thực bào tham gia vào việc phòng vệ bẩm sinh của cơ thể bằng cách loại bỏ một vài mầm bệnh nhất định, một quá trình tế bào được biết đến với tên gọi là "xenophagy". Gia đình Toll-like receptor, các protein màng hoạt hóa bởi kháng nguyên vi khuẩn, kích thích sự thực bào. Cuối cùng, hiện tượng tự thực bào tham gia vào cơ chế miễn dịch thích nghi bằng cách kiểm soát sự lưu thông nội bào của các peptide có nguồn gốc từ sự suy thoái của các kháng nguyên trong nguyên sinh chất và trình diện chúng thông qua các phân tử của phức hợp phù hợp mô chính lớp II + (MHC lớp II+).31
Hiện tượng tự thực bào và các bệnh lý hô hấp
Hiện tượng sinh học được biết đến trong hơn một nửa thế kỷ,19 vai trò của hiện tượng tự thực bào trong sinh lý bệnh học của các bệnh lý hô hấp chỉ bắt đầu được biết đến nhiều hơn trong vài năm gần đây.32,38 Hiện tượng tự thực bào, cũng như chết tế bào theo chương trình, đóng vai trò thiết yếu trong sinh bệnh học của COPD.32, 38 Khói thuốc lá gây ra cái chết tự thực bào của các tế bào biểu mô38 và thúc đẩy sự phát triển khí phế thũng bằng cách kích hoạt một protein dạng vi ống (microtubule-associated protein1 light chain B, LC3B) được mã hóa bởi các gen Atg6 (trong gia đình của gen tự thực bào ATG, xem ở trên).39 Vai trò của hiện tượng tự thực bào trong ung thư là mâu thuẫn. Một mặt, hiện tượng tự thực bào có thể đóng một vai trò tích cực trong (1) làm chậm sự tăng trưởng khối u, (2) bảo vệ DNA trước những tổn hại gây ra bởi các lọai phản ứng oxy hóa và (3) thúc đẩy sự phá hủy các tế bào ung thư. Ngược lại, hiện tượng tự thực bào có thể làm tăng khả năng kháng thuốc hóa trị và do đó làm phát triển ung thư.40
KẾT LUẬN
Nghiên cứu cơ bản thường bị (sai lầm) xem là không có kết nối với thực tế y học lâm sàng. Tuy nhiên, tất cả chúng ta nhất trí nhận ra tầm quan trọng của sự hiểu biết tốt hơn về cơ chế sinh học sẽ giúp cho việc chăm sóc cho bệnh nhân và bệnh tật của họ được tốt hơn. Những bác sĩ nghiên cứu viên, những người mà có thể làm tròn vai trò người chuyển giao kiến thức hay người chuyển đổi tri thức, có một vai trò rất quan trọng trong bối cảnh này.
Đinh Xuân Anh Tuấn*
* Khoa Sinh Lý Lâm sàng – Thăm dò chức năng hô hấp và tim mạch. Bệnh viện Cochin, Đại học Paris Descartes, This email address is being protected from spambots. You need JavaScript enabled to view it.
TÀI LIỆU THAM KHẢO
1. McClintock B. The behavior in successive nuclear divisions of a chromosome broken at meiosis. Proc Natl Acad Sci USA 1939; 25: 405–16.
2. Abbott A. Chromosome protection scoops Nobel. Nature 2009; 461: 706–7.
3. Calado RT, Young NS. Telomere diseases. N Engl J Med 2009; 361: 2353–65.
4. Ito K, Barnes PJ. COPD as a disease of accelerated lung aging. Chest 2009; 135: 173–80.
5. Fukuchi Y. The aging lung and chronic obstructive pulmonary disease: similarity and difference. Proc Am Thorac Soc 2009; 6: 570–2.
6. Barnes PJ. Senescence in COPD and its comorbidities. Annu Rev Physiol 2017; 79: 517–39.
7. Morlá M, Busquets X, Pons J, Sauleda J, MacNee W, Agustí AG: Telomere shortening in smokers with and without COPD. Eur Respir J 2006; 27: 525–8.
8. Houben JM, Mercken EM, Ketelslegers HB, Bast A, Wouters EF, Hageman GJ, Schols AM. Telomere shortening in chronic obstructive pulmonary disease. Respir Med 2009; 103: 230– 6.
9. Savale L, Chaouat A, Bastuji-Garin S, Marcos E, Boyer L, Maitre B, Sarni M, Housset B, Weitzenblum E, Matrat M, Le Corvoisier P, Rideau D, Boczkowski J, Dubois-Randé JL, Chouaid C, Adnot S. Shortened telomeres in circulating leukocytes of patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2009; 179: 566–71.
10. Leung J, Tan WC, Bourbeau J, Liu J, Man SP, Sin DD. Peripheral leukocyte telomere length is associated with short term lung function decline (Abstract). Am J Respir Crit Care Med 2017; 195: A1010.
11. Lee E, Ra S, Fishbane N, Tam S, Criner GJ, Woodruff PG, Lazarus SC, Albert R, et al. The relationship of absolute telomere length with quality of life, exacerbations, and mortality in chronic obstructive pulmonary disease (COPD) (Abstract). Am J Respir Crit Care Med 2017; 195: A1010.
12. Armanios MY, Chen JJ, Cogan JD, Alder JK, Ingersoll RG, Markin C, Lawson WE, Xie M, Vulto I, Phillips JA 3rd, Lansdorp PM, Greider CW, Loyd JE. Telomerase mutations in families with idiopathic pulmonary fibrosis. N Engl J Med 2007; 356: 1317–26.
13. Tsakiri KD, Cronkhite JT, Kuan PJ, Xing C, Raghu G, Weissler JC, Rosenblatt RL, Shay JW, Garcia CK. Adult-onset pulmonary fibrosis caused by mutations in telomerase. Proc Natl Acad Sci USA 2007; 104: 7552–7.
14. Cronkhite JT, Xing C, Raghu G, Chin KM, Torres F, Rosenblatt RL, Garcia CK. Telomere shortening in familial and sporadic pulmonary fibrosis. Am J Respir Crit Care Med 2008; 178: 729–37.
15. Armanios M. Telomerase and idiopathic pulmonary fibrosis. Mutat Res 2012; 730: 5 –8 .
16. Armanios M, Blackburn EH. The telomere syndromes. Nat Rev Genet 2012; 13: 693–704.
17. Armanios M. Telomeres and age-related disease: how telomere biology informs clinical paradigms. J Clin Invest 2013; 123: 996–1002.
18. Bonniaud P. Autophagie: autocanibalisme ou autodéfense ? Rev Mal Respir 2008; 25: 8–10.
19. De Duve C, Wattiaux R. Functions of lysosomes. Annu Rev Physiol 1966; 28: 435.
20. http://nobelprize.org/nobel_prizes/medicine/laureates/1974/
21. Takeshige K, Baba M, Tsuboi S, Noda T, Ohsumi Y. Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. J Cell Biol 1992; 119: 301–11.
22. Tooze SA, Dikic I. Autophagy Captures the Nobel Prize. Cell 2016; 167: 1433–5.
23. Klionsky DJ. Autophagy: from phenomenology to molecular understanding in less than a decade. Nat Rev Mol Cell Biol 2007; 8: 931–7.
24. Mizushima N, Levine B, Cuervo AM, Klionsky DJ. Autophagy fights disease through cellular self-digestion. Nature 2008; 451: 1069–75.
25. Hotchkiss RS, Strasser A, McDunn JE, Swanson PE. Cell death. N Engl J Med 2009; 361: 1570–83 .
26. Maiuri MC, Zalckvar E, Kimchi A, Kroemer G. Self-eating and self-killing: crosstalk between autophagy and apoptosis. Nat Rev Mol Cell Biol 2007; 8: 741–52.
27. Codogno P. Les gènes ATG et la macro-autophagie. Med Sci (Paris) 2004; 20: 734–6. 2
8. Pattingre S, Tassa A, Qu X, Garuti R, Liang XH, Mizushima N, Packer M, Schneider MD, Levine B. Bcl-2 antiapoptotic proteins inhibit Beclin 1-dependent autophagy. Cell 2005; 122: 927–39.
29. Qu X, Zou Z, Sun Q, Luby-Phelps K, Cheng P, Hogan RN, Gilpin C, Levine B. Autophagy gene-dependent clearance of apoptotic cells during embryonic development. Cell 2007; 128: 931–46.
30. Levine B, Deretic V. Unveiling the roles of autophagy in innate and adaptive immunity. Nat Rev Immunol 2007; 7: 767–77.
31. Xu Y, Eissa NT. Autophagy in innate and adaptive immunity. Proc Am Thorac Soc 2010; 7: 22–8.
32. Ryter SW, Choi AM. Autophagy in the Lung. Proc Am Thorac Soc 2010; 7: 13–21.
33. Pandit L, Bonilla DL, Eissa NT. Autophagy: a new frontier in research in lung diseases. Am J Respir Crit Care Med 2011; 183: 566 –8.
34. Mizumura K, Cloonan S, Choi ME, Hashimoto S, Nakahira K, Ryter SW, Choi AM. Autophagy: friend or foe in lung disease? Ann Am Thorac Soc 2016;13 (Suppl 1): S40–7.
35. Aggarwal S, Mannam P, Zhang J. Differential regulation of autophagy and mitophagy in pulmonary diseases. Am J Physiol Lung Cell Mol Physiol 2016; 311: L433–52.
36. Kuwano K, Araya J, Hara H, Minagawa S, Takasaka N, Ito S, Kobayashi K, Nakayama K. Cellular senescence and autophagy in the pathogenesis of chronic obstructive pulmonary disease (COPD) and idiopathic pulmonary fibrosis (IPF). Respir Investig 2016; 54: 397–406.
37. Ryter SW, Lam HC, Chen ZH, Choi AM. Deadly triplex: smoke, autophagy and apoptosis. Autophagy 2011; 7: 436–7.
38. Chen ZH, Kim HP, Sciurba FC, Lee SJ, Feghali-Bostwick C, Stolz DB, Dhir R, Landreneau RJ, Schuchert MJ, Yousem SA, Nakahira K, Pilewski JM, Lee JS, Zhang Y, Ryter SW, Choi AM. Egr-1 regulates autophagy in cigarette smoke-induced chronic obstructive pulmonary disease. PLoS One 2008; 3: e3316.
39. Chen ZH, Lam HC, Jin Y, Kim HP, Cao J, Lee SJ, Ifedigbo E, Parameswaran H, Ryter SW, Choi AM. Autophagy protein microtubule-associated protein 1 light chain-3B (LC3B) activates extrinsic apoptosis during cigarette smoke-induced emphysema. Proc Natl Acad Sci USA; 107: 18880–5.
40. Maycotte P, Thorburn A. Autophagy and cancer therapy. Cancer Biol Ther 2011; 11: 127–37.