- Chi tiết
-
Được đăng: 16 Tháng 11 2017
Tóm tắt:
Đợt cấp bệnh phổi tắc nghẽn mạn tính (BPTNMT) là một diễn biến thường gặp của BPTNMT và để lại nhiều hậu quả nặng nề cho người bệnh như suy giảm chất lượng cuộc sống, sụt giảm nhanh chức năng hô hấp, chiếm phần lớn chi phí điểu trị bệnh và là nguyên nhân gây tử vong chính cho bệnh nhân. Khi đợt cấp xảy ra, quá trình viêm trong đường hô hấp và viêm toàn thân diễn ra mạnh mẽ hơn với nhiều thay đổi so với giai đoạn ổn định. Tuỳ theo nguyên nhân gây ra đợt cấp là vi trùng, virus hay các tác nhân không viêm nhiễm mà kiểu viêm xảy ra trong đợt cấp cũng rất khác nhau. Có thể tạm thời chia làm 2 kiểu viêm chính thường gặp trong đợt cấp BPTNMT là viêm theo hướng tăng bạch cầu ái toan và viêm theo hướng tăng bạch cầu đa nhân trung tính. Kiểu viêm theo hướng tăng bạch cầu ái toan đáp ứng tốt với corticoid và thường xảy ra khi nguyên nhân gây ra đợt cấp là virus. Các thuốc chống viêm cho kiểu viêm còn lại đang được nghiên cứu.
Abstract:
Acute exacerbations are very common in progression of and an important feature of chronic obstructive pulmonary disease (COPD) since they result in deterioration of a patient’s quality of life, contribute to decline in lung function, lead to majority of all COPD-related costs and to be a main cause of mortality in this disease. During exacerbation, the inflammatory process in both airway and body system are dramatically enhanced and changed compared to that in stable stage. The major causes of exacerbations are viral and bacterial infection, air pollution and unidentified causes. Certainly, the different known causes of exacerbation will result in various types of inflammation. However, there are two main types of inflammation in COPD exacerbations should be remember are eosinophilic inflammation and neutrophilic inflammation. That eosinophilic inflammation which is usually happen in virus induced exacerbation is well controlled by corticosteroid but the drugs for neutrophilic inflammation are under developed.
1. Giới thiệu
Bệnh phổi tắc nghẽn mạn tính (BPTNMT) được định nghĩa là bệnh đặc trưng bởi tình trạng giới hạn luồng khí dai dẳng và tiến triển liên quan đến tình trạng đáp ứng viêm quá mức và mạn tính của đường thở và phổi đối với các hạt và khí độc. Tình trạng viêm này diễn ra thường trực trong giai đoạn ổn định và gia tăng (kèm thay đổi đáng kể) khi bệnh nhân vào đợt cấp [1]. BPTNMT là một vấn đề sức khoẻ toàn cầu với tỷ lệ ngày càng gia tăng và tỷ lệ tử vong ước tính chiếm 5% tử vong toàn cầu. Đây là nguyên nhân gây tử vong đứng hàng thứ 4 trên thế giới và dự kiến sẽ tăng lên hàng thứ 3 vào năm 2020 [1].
Về định nghĩa, đợt cấp “là tình trạng nặng lên của các triệu chứng hơn mức dao động tới hàng ngày đòi hỏi phải thay đổi điều trị” [1] và theo Anthonisen thì đợt cấp xảy ra khi người bệnh có mức độ khó thở tăng, lượng đàm tăng hay có đàm mủ [2]. Đợt cấp bệnh phổi tắc nghẽn mạn tính (BPTNMT) là một diễn biến thường gặp của BPTNMT và để lại nhiều hậu quả nặng nề cho người bệnh như suy giảm chất lượng cuộc sống, sụt giảm nhanh chức năng hô hấp, chiếm phần lớn chi phí điểu trị bệnh và là nguyên nhân gây tử vong chính cho bệnh nhân.
Mặc dù phản ứng viêm được xem là một đặc tính chính trong đợt cấp và corticoid đường toàn thân luôn được khuyến cáo sử dụng trong đợt cấp để khống chế tình trạng viêm này nhưng hầu như không có định nghĩa đợt cấp nào có đề cập đến tình trạng viêm. Gần đây đã có tác giả cố gắng sử dụng biomarker viêm của đường hô hấp để xác định đợt cấp BPTNMT và cho thấy CRP máu kết hợp với một triệu chứng lâm sàng chính có thể hữu ích để xác định đợt cấp [3]. Đợt cấp gây ra nhiều hệ luỵ cho người bệnh và có liên quan chặt chẽ với tình viêm của đường hô hấp cũng như viêm toan thân nên cơ chế viêm cần được chú trọng trong quản lý đợt cấp. Tìm hiểu cơ chế viêm này sẽ giúp chúng ta hiểu được cơ chế bệnh học gây ra đợt cấp đồng thời giúp tìm kiếm 1 giải pháp chống viêm trong tương lai để điều trị cho bệnh nhân.
Bài viết này mô tả đặc điểm của viêm của BPTNMT trong giai đoạn cấp cũng như mối liên quan giữa tình trạng viêm này với các biểu hiện lâm sàng của bệnh nhân.
2. Quá trình viêm xảy ra trong đợt cấp BPTNMT.
Ngày nay, nhờ kỹ thuật sinh thiết phổi, phân tích đàm và tử thiết nên quá trình viêm mạn tính của đường thở và phổi ở BPTNMT đã được chứng minh [4]. Khi các hạt và khí độc có trong khói thuốc lá hay vài chất khác tiếp xúc với niêm mạc đường hô hấp, nó sẽ khởi động một quá trình viêm chuyên biệt ở đường dẫn khí nhỏ và nhu mô phổi với nhiều loại tế bào khác nhau tham gia bao gồm các tế bào lympho mà đặc biệt bạch cầu đa nhân trung tính (BCĐNTT) và đại thực bào [5,6]. Quá trình viêm làm thay đổi cấu trúc và chức năng đường hô hấp qua 4 cơ chế chính [5]: (1) tăng mức độ dày của thành phế quản (2) tăng trương lực cơ trơn phế quản, (3) tăng tiết nhày và (4) mất các cấu trúc đàn hồi. Các cơ chế này hình thành nên cơ chế bệnh sinh của BPTNMT và biểu hiện thành các triệu chứng lâm sàng và cận lâm sàng của bệnh nhân.
Các nghiên cứu cho thấy quá trình viêm bắt đầu xảy ra ở người hút thuốc lá và tăng dần ở khi người đó mắc BPTNMT (bệnh càng nặng viêm càng nhiều) và đặc biệt là tăng cao trong đợt cấp (hình 1). Những người hút thuốc và mắc BPTNMT giai đoạn ổn định sẽ viêm mạn tính và tiến triển ảnh hưởng đến toàn bộ cây hô hấp và đặc trưng bởi sự gia tăng các đại thực bào và các tế bào lympho T CD8 trong thành đường hô hấp và bạch cầu đa nhân trung tính trong lòng đường hô hấp. Đặc điểm về tế bào này thay đổi trong đợt cấp, khi bạch cầu ái toan và bạch cầu trung tính trở thành thành phần chính trong các đáp ứng viêm [7,8]. Bất kỳ kích thích nào làm tăng viêm đường hô hấp cấp tính đều có thể dẫn đến tăng trương lực phế quản, tăng phù nề thành phế quản và tăng tạo chất nhầy. Các quá trình này cũng có thể làm trầm trọng thêm sự mất cân bằng giữa thông khí - tưới máu và hạn chế thông khí thở ra. Các biểu hiện lâm sàng tương ứng sẽ bao gồm trao đổi khí khó khăn hơn, khó thở tăng, ho và tăng tiết đàm hay xuất hiện đàm nhầy mủ; đây là các biểu hiện chủ yếu của một đợt kịch phát.
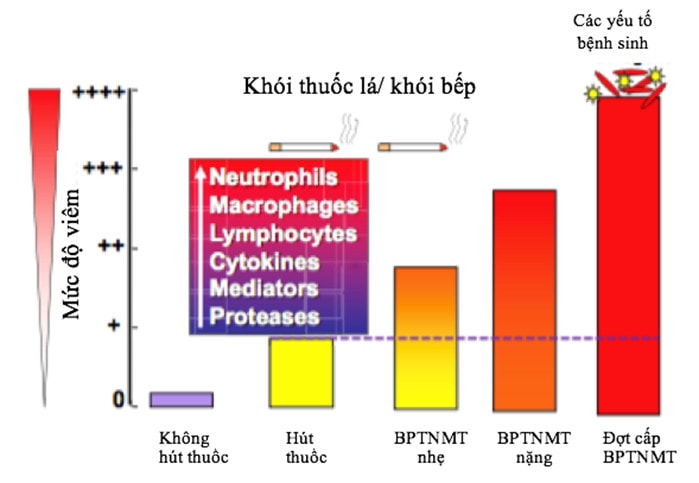
Hình 1: Tình trạng viêm gia tăng ở bệnh nhân BPTNMT so với người hút thuốc lá không bị BPTNMT hay không hút thuốc lá. Một khi đã hình thành, quá trình viêm sẽ tiếp diễn dù ngưng hút thuốc lá và viêm xảy ra nhiều hơn khi bệnh nhân có đợt cấp do vi trùng hay virus [6]
Cơ chế viêm xảy ra trong BPTNMT ở giai đoạn ổn định hay khi vào đợt cấp tương đối phức tạp và hiện chưa được hiểu biết một cách đầy đủ. Hơn nữa, về nguyên nhân thì đa phần đợt cấp do nhiễm siêu vi hay vi trùng nhưng nhiều trường hợp không xác định được nguyên nhân [1] nên đặc tính viêm cũng rất khác nhau khi các nguyên nhân gây ra đợt cấp khác nhau. Nhiều tế bào viêm như BCĐNTT, lymphocyte và bạch cầu ái toan (BCAT) gia tăng trong đợt cấp và các chất trung gian viêm như các chât hoá hướng động của BCĐNTT (IL-8, và leukotriene -B4), các sản phẩm ly giải hạt của BCĐNTT (bao gồm myeloperoxidase) và các marker viêm hệ thống (IL-6, CRP) cũng như chemokine (eotaxin và RANTES - Regulated upon Activation, Normal T-cell Expressed, and Secreted) cũng gia tăng so với BPTNMT giai đoạn ổn định [9]. Kiểu hình BPTNMT cũng liên quan đến tình trạng viêm của đường hô hấp trong giai đoạn ổn định nói chung và đợt cấp nói riêng. Nhóm bệnh nhân bị BPTNMT kiểu hình có nhiều đợt cấp có mức độ viêm nhiều hơn nhóm có kiểu hình ít đợt cấp. Điều này gợi ý có một sự liên quan giữa mức độ viêm và tần suất đợt cấp BPTNMT. Tuy nhiên vì có sự trùng lắp trong các cơ chế tạo ra quá trình viêm nên không thể dựa vào mức độ viêm để tiên đoán bệnh nhân sẽ có nhiều đợt cấp hay không [4].
Dù tương đối phức tạp trong cơ chế viêm khi bệnh nhân BPTNMT vào đợt cấp nhưng có 2 kiểu viêm chính cần phân biệt trong giai đoạn này là viêm theo hướng tăng bạch cầu ái toan (eosinophilic inflammation) và viêm theo hướng tăng bạch cầu đa nhân trung tính (neutrophilic inflammation) [10,11].
- Viêm theo hướng tăng bạch cầu ái toan - Eosinophilic inflammation
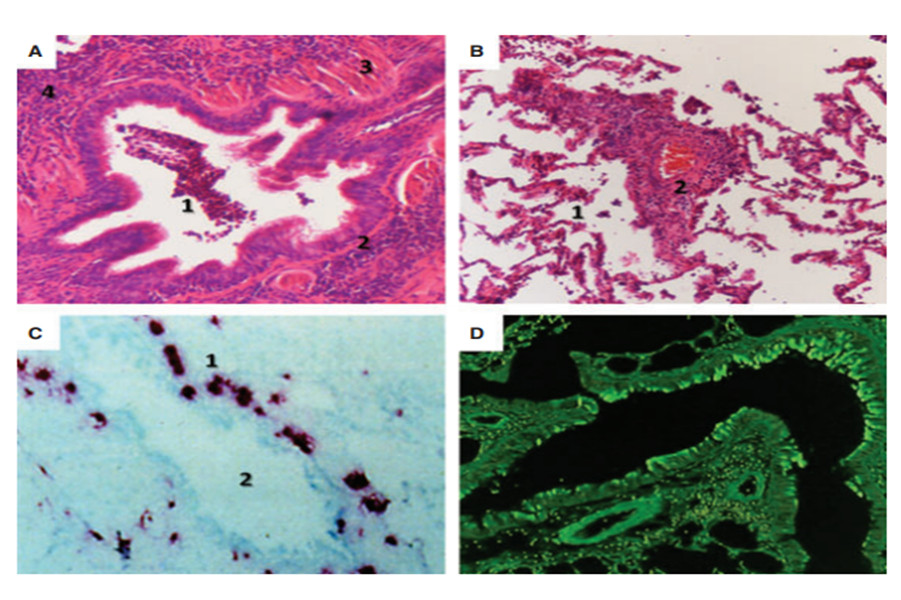
Một kiểu viêm có thể giải thích được nhiều đặc tính của đợt cấp BPTNMT là tình trạng viêm theo kiểu tăng BCAT. Các nghiên cứu về sinh thiết niêm mạc đường hô hấp cho thấy BCAT ở niêm mạc phế quản tăng 30 lần trong đợt cấp [4] (xem hình 2) và một sản phẩm của BCAT là eosinophilic cationic protein (ECP) - protein tích điện dương của BCAT – cũng tăng trong máu khi bệnh nhân vào đợt cấp [12]. Mặc dù điều này gợi ý "biểu hiện của hen" nhưng trong bệnh cảnh này các bạch cầu ái toan không phóng hạt (như trong bệnh hen) và không kèm theo tăng IL-5 [13].
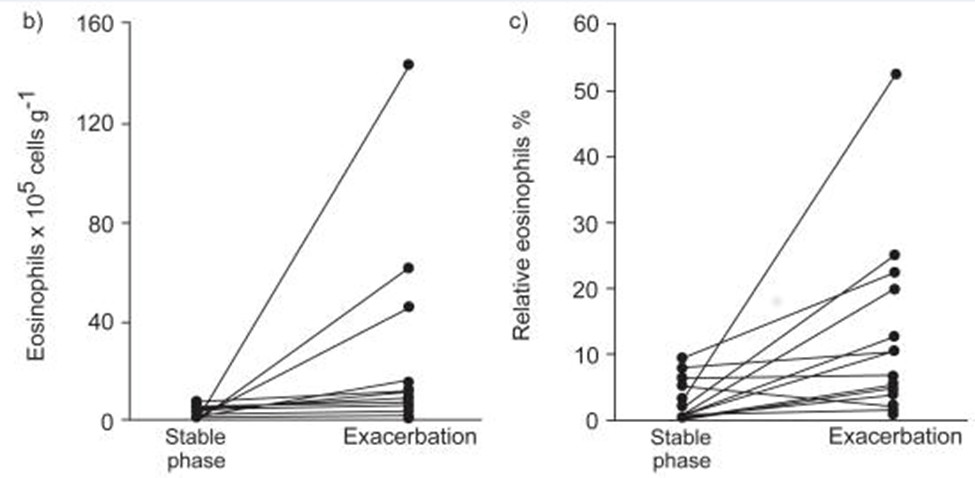
Hình 2: Thay đổi bạch cầu ái toan trong đàm từ giai đoạn ổn định sang giai đoạn cấp của bệnh phổi tắc nghẽn mạn tính [4]
Sự gia tăng BCAT trong đợt cấp (như hình 2) gợi ý rằng có một nhóm bệnh nhân có BCAT gia tăng trong đường thở. Sự gia tăng này trong đợt cấp BPTNMT có thể có liên quan đến nguyên nhân là siêu vi gây ra đợt cấp [14,15]. Khi virus xâm nhập vào đường thở, nó bị nhận diện bởi các Toll-like receptors trên các tế bào biểu mô và sau đó các tế bào này tạo ra rất nhiều các cytokine tiền viêm [16,17]. Các chemokine lôi kéo BCAT như RANTES, eotaxin và interleukin-5 (IL-5) cũng được tìm thấy gia tăng trong suốt đợt cấp [18]. RANTES có thể thúc đẩy việc tập kết bạch cầu ái toan làm gia tăng số lượng các tế bào này ở niêm mạc đường hô hấp trong cơn kịch phát [19]. Vai trò của bạch cầu ái toan vẫn còn đang được xác định, nhưng một số sản phẩm của bạch cầu ái toan (peroxidase của bạch cầu ái toan, protein cơ bản, eosinophil cationic protein (ECP), metalloproteinase, yếu tố kích hoạt tiểu cầu, và cysteinyl leukotrienes) có thể gây tổn thương đường hô hấp do cơ chế viêm [20] và cùng với histamin có thể gây ra co thắt phế quản. Tăng eotaxin-1, một chemokine CC tham gia vào việc tập kết và kích hoạt bạch cầu ái toan, và thụ thể CCR3 của eotaxin-1 cũng đã được phát hiện ở các đợt cấp [21]. Viêm theo hướng tăng BCAT dường như là đặc trưng của đợt cấp do virus và trái lại BCĐNTT và các sản phẩm trung gian của BCĐNTT được ghi nhận có vai trò ở các đợt cấp cả do vi trùng và virus [10,11].
Mặc dù có những bằng chứng như trên nhưng không phải ai cũng biết tế bào viêm đích cần nhắm đến trong điều trị đợt cấp. BCAT liên quan nhiều đến đợt cấp và đây là tế bào nhạy cảm nhất với corticoid trong đường thở do vậy hiệu quả điều trị của corticoid trong đợt cấp chủ yếu liên quan đến nhóm tế bào này. Trong BPTNMT giai đoạn ổn định, số lượng tế bào BCAT cao có liên quan đến đáp ứng với corticoid cả đường toàn thân hay đường hít (ICS) [22] và trong giai đoạn cấp, nhiều bằng chứng cho thấy prednisolone và phối hợp ICS/ LABA (LABA là thuốc dãn phế quản tác dụng kéo dài) giảm được BCAT trong đàm [23].
- Viêm theo hướng tăng bạch cầu đa nhân trung tính - Neutrophilic inflammation
Một phát hiện quan trọng khác trong chất tiết đường hô hấp và mẫu sinh thiết phế quản ở đợt cấp BPTNMT là tăng BCĐNTT [22]. Sự gia tăng này liên quan đến việc tạo đàm hay tăng độ đặc của đàm [22,24]. Các BCĐNTT phóng thích hạt tạo ra các elastase và proteinases có thể gây tổn thương biểu mô, giảm cử động các vi nhung mao, kích thích các tế bào đài tăng tiết nhầy và tăng tính thấm của niêm mạc phế quản gây ra phù đường thở và xuất tiết protein vào đường thở [25]. Những thay đổi này đặc biệt ở đường dẫn khí nhỏ sẽ làm tăng tình trạng khó thở, tăng lượng đàm cũng như thay đổi màu sắc (tính chất) đàm trong đợt cấp.
Tầm quan trọng của bạch cầu trung tính trong đợt cấp BPTNMT cũng được nhấn mạnh bởi việc phát hiện tỷ lệ bạch cầu trung tính ở phế trường ngoại biên có tương quan tuyến tính nghịch với mức độ nặng của tắc nghẽn đường hô hấp [26] và sự thay đổi của số lượng BCĐNTT ở đàm trong đợt cấp (so với giai đoạn ổn định) tỷ lệ thuận với mức sụt giảm chức năng hô hấp trong đợt cấp (hình 3) [27].
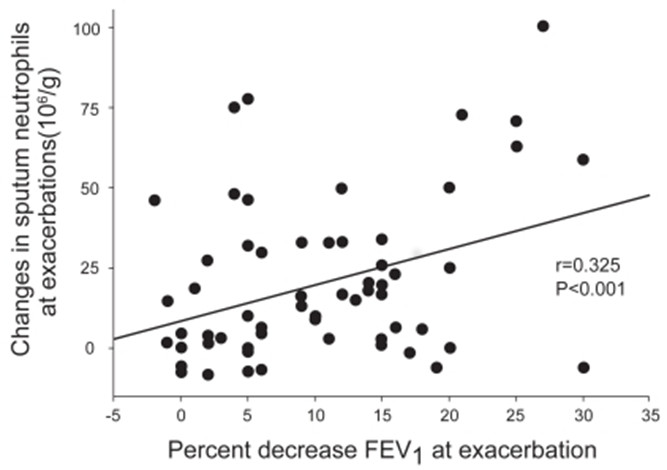
Hình 3: Sự gia tăng bạch cầu đa nhân trung tính ở đàm trong đợt cấp tỷ lệ thuận với mức độ sụt giảm FEV1 trong đợt cấp [27].
Việc tập kết BCĐNTT trong đợt cấp BPTNMT thông qua trung gian rất nhiều phân tử khác nhau. Trên thực tế, hai chất hóa hướng động BCĐNTT quan trọng là CXCL5 (ENA-78) và CXCL8 (IL-8) và các thụ thể của chúng CXCR1 và CXCR2 đã được tìm thấy trong mẫu sinh thiết phế quản ở những đợt kịch phát BPTNMT mức độ nặng [28]. Tương tự, người ta cũng phát hiện nồng độ CXCL8 tăng lên trong các đường dẫn khí lớn trong cả các đợt cấp nặng và rất nặng [26]. Hơn nữa, đợt cấp cũng liên quan đến sự gia tăng LTB4 [25], một cytokine liên quan đến viêm theo hướng tăng BCĐNTT nhiều nhất trong đợt cấp. GM-CSF (granulocyte/ macrophage colony stimulating factor) là một cytokine có chức năng thúc đẩy quá trình biệt hoá các tế bào bạch cầu hạt và đại thực bào cũng như kích hoạt trực tiếp chúng cũng gia tăng trong đợt cấp. Đây cũng là một cơ chế góp phần làm cho BCĐNTT – cũng như BCAT và đại thực bào – tác động làm thay đổi quá trình viêm xảy ra trong đường thở khi bệnh nhân vào đợt cấp [25]. Hình 3 mô tả sự thay đổi xảy ra trong quá trình viêm theo hướng tăng bạch cầu đa nhân trung tính trong đợt cấp. Mặc dù BCĐNTT lên quan đến tình trạng nhiễm trùng cả trong giai đoạn ổn định hay cấp nhưng BCĐNTT vẫn thấy gia tăng khi bệnh nhân vào đợt cấp do virus hay không rõ nguyên nhân [29]. Tình trạng viêm đường thở và viêm toàn thân xảy ra mạnh hơn trong đợt cấp liên quan đến các chủng vi trùng mới (đối với bệnh nhân) so với trong đợt cấp do các chủng vi trùng thường trú hay đợt cấp không do nhiễm trùng. Các đợt cấp liên quan đến các chủng vi trùng thường trú có một quá trình viêm tương tự như các đợt cấp không rõ nguyên nhân gợi ý rằng các chủng vi trùng thường trú có thể không phải là tác nhân gây bệnh [30].
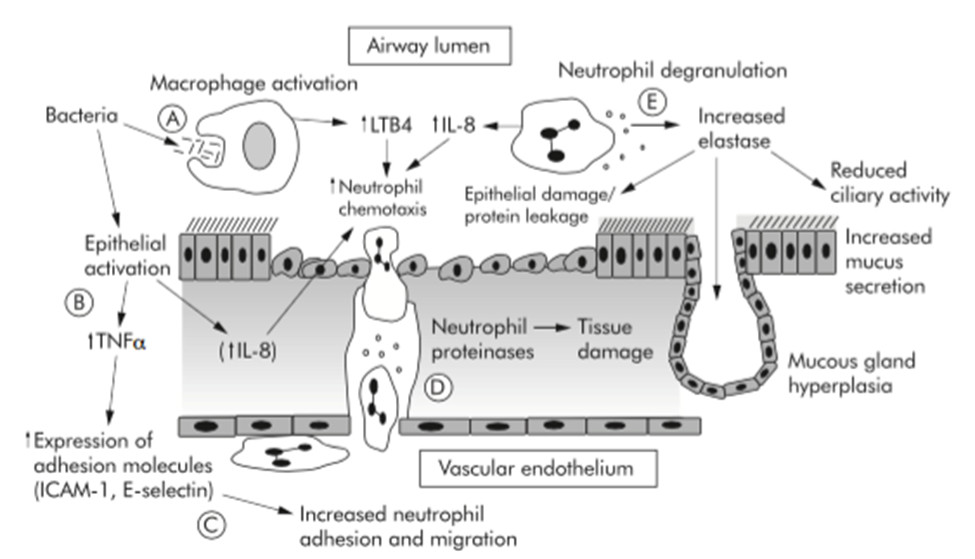
Hình 4: Viêm theo hướng tăng bạch cầu đa nhân trung tính trong đợt cấp. (A) Sự hoạt hoá các thực bào/đại thực bào (phóng thích LTB4 và TNFα). (B) Hoạt hoá các tế bào biểu mô (để đáp ứng với TNFα và các chát tiết của vi trùng, phóng thích TNFα và IL-8). (C) Hoạt hoá các tế bào nội mô (do TNFα, tăng các phân tử kết dính). (D) Di chuyển BCĐNTT (sau khi bám vào các phân tử kết dính và gradient hoá hướng động IL-8/LTB4, phóng thích elastase và gây tổn thương mô). (E) phóng thích Neutrophil elastase vào đường thở (tổn thương biểu mô và thoát protein; tăng tiết nhầy; giảm thanh thải nhầy; phóng thích IL-8 và LTB4 gây tăng tín hiệu hoá hướng động). Viết tắt: LTB4=leukotriene B4; IL-8=interleukin 8; TNFα=tumour necrosis factor α; ICAM-1=intercellular adhesion molecule 1.
Các nghiên cứu cắt ngang cho thấy có sự liên quan giữa các marker viêm đường thở và mức độ nặng của đợt cấp. Các marker viêm đường thở như IL-8 đàm và IL-6 đàm có liên quan ngược với chức năng phổi trước đợt cấp và điều này cho thấy mức độ đáp ứng viêm cấp tính trong đợt cấp liên quan với mức độ chức năng phổi trong giai đoạn ổn định [4,31]. Ngoài ra, IL-8 và IL-6 gia tăng nhiều hơn trong kiểu hình BPTNMT nhiều đợt cấp so với kiểu hình ít đợt cấp và càng nhiều marker viêm như IL-6 đàm và IL-8 đàm thì thời gian hồi phục sau đợt cấp càng lâu [4].
Leukotrien cũng là một yếu tố hóa hướng động của các tế bào viêm trong đợt cấp BPTNMT. Không chỉ leukotriene B4 mà leukotriene E4 cũng gia tăng trong đợt cấp và liên quan mức độ giảm oxy máu và mức độ tắc nghẽn đường thở trong đợt cấp [32].
Một trong những vai trò quan trọng của BCĐNTT là diệt khuẩn. Để tiêu diệt vi trùng, các BCĐNTT phóng thích hoạt, giải phóng myeloperoxidase là 1 chất có tính oxy hóa cao [33] gia tăng ở đàm và máu trong đợt cấp BPTNMT [34]. Nếu đợt cấp BPTNMT gây ra bởi vi trùng thì sẽ có sự gia tăng BCĐNTT trong đàm và tạo ra đáp ứng viêm toàn thân biểu hiện bằng các marker viêm của BCĐNTT trong máu như CRP, fibrinogen và IL- 6 tăng trong đợt cấp [35]. Nhiều cơ chế được đưa ra để giải thích sự gia tăng tình trạng viêm toàn thân bao gồm: 1) các trung gian viêm tràn ra từ phổi; 2) phản ứng viêm do tình trạng thiếu oxy mô và 3) phản ứng do lipopolysaccharide là sản phẩm tiền viêm từ vi trùng [36]
Thêm vào đó, đã có bằng chứng về mối liên hệ giữa tình trạng viêm hệ thống và nguy cơ đợt cấp BPTNMT. Những bệnh nhân BPTNMT và có hội chứng chuyển hóa có biểu hiện viêm toàn thân nhiều hơn (CRP tăng), đợt cấp nhiều hơn và thời gian nằm viện vì đợt cấp dài hơn so với các bệnh nhân BPTNMT không có hội chứng chuyển hóa. Các marker viêm toàn thân như IL-8, IL-6 và IL-5, CRP, TNF-a và neutrophil elastase trong máu cũng có liên quan với tình trạng cải thiện lâm sàng và chức năng phổi sau đợt cấp [4]. Tình trạng gia tăng lâu dài các marker viêm toàn thân (IL-8 đàm, TNF-a máu, neutrophil elastase và CRP máu) là đặc trưng của nhóm bệnh nhân BPTNMT nhiều đợt cấp và có liên quan đến nguy cơ mắc đợt cấp tiếp theo sau 1 thời gian ngắn.
3. Các điều trị mới chống viêm trong BPTNMT đang nghiên cứu ngoài corticoid [4]
Có nhiều loại thuốc chống viêm mới trong BPTNMT đã và đang xuất hiện như anticytokine và antichemokine. Một nghiên cứu thử nghiệm trên bệnh nhân BPTNMT với ABX- IL8, một kháng thể đơn dòng chống IL-8, cho thấy thuốc giảm được tình trạng khó thở thông qua cơ chế chống viêm. TNF là một cytokine tham gia vào quá trình viêm nên điều trị chống TNF là một lựa chọn đang được quan tâm trong điều trị BPTNMT. Thuốc Etanercept, một thuốc chống TNF, có thể ngăn chặn các TNF hòa tan hay bám vào tế bào đã làm giảm được tỉ lệ nhập viện cho bệnh nhân BPTNMT. Tuy nhiên, kháng thể kháng TNF, infliximab, không cải thiện được chất lượng cuộc sống hay khả năng gắng sức cũng như nguy cơ xuất hiện đợt cấp cho bệnh nhân BPTNMT và có nguy cơ gây ra ung thư và viêm phổi. Vì vậy cần có nhiều nghiên cứu hơn nữa để tạo ra các thuốc điều trị hướng về các tác nhân viêm đặc hiệu này ở bệnh nhân BPTNMT.
4. Kết luận
Nhiều tế bào và hoá chất trung gian gây viêm tham gia vào cơ chế viêm của BPTNMT giai đoạn cấp cũng như giai đoạn ổn định. Khi bệnh nhân vào đợt cấp, quá trình viêm diễn tiến nặng hơn và có nhiều thay đổi về tế bào viêm cũng như các chất trung gian so với giai đoạn ổn định. Tuỳ theo nguyên nhân gây ra đợt cấp là vi trùng, virus hay không phải tác nhân viêm nhiễm mà kiểu viêm của đường hô hấp cũng như toàn thân trong đợt cấp sẽ khác nhau. Cơ bản có 2 kiểu viêm chính là viêm theo hướng tăng BCAT thường gặp khi nhiễm virus đơn thuần và kiểu viêm theo hướng tăng BCĐNTT thường gặp khi nhiễm vi trùng hay cả vi trùng và virus. Tình trạng viêm mà đặc biệt viêm toàn thân góp phần làm cho đợt cấp nặng hơn do vậy do vậy người thầy thuốc cần hiểu được tầm quan trọng của việc điều trị để đạt được mục tiêu giảm nền viêm này nhằm làm giảm đợt cấp và làm chậm diễn tiến của bệnh. Hiện có vài loại thuốc đã được chứng minh làm được điều này và nhiều loại thuốc có triển vọng đang được thử nghiệm trên lâm sàng.
ThS. BS. Nguyễn Như Vinh
Trung Tâm Đào Tạo Bác Sĩ Gia Đình – Đại Học Y Dược Tp. Hồ Chi Minh
Khoa Thăm Dò Chức Năng – Bệnh Viện Đại Học Y Dược Tp. Hồ Chi Minh
Email: This email address is being protected from spambots. You need JavaScript enabled to view it.
Tài liệu tham khảo
1. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2017. Available from: http://goldcopd.org.
2. Anthonisen NR, Manfreda J, Warren CP, et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med. 1987;106:196–204.
3. Hurst JR, Donaldson GC, Perea WR, et al. Utility of plasma biomarkers at exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2006a;174:867–74.
4. Sethi S, Mahler DA, Marcus P, Owen CA, Yawn B, Rennard S. Inflammation in COPD: implications for management. Am J Med. 2012;125(12):1162-70.
5. Roche N, Marthan R, Berger P, Chambellan A, Chanez P, Aguilaniu B, et al. Beyond corticosteroids: future prospects in the management of inflammation in COPD. European Respiratory Review. 2011;20(121):175-82.
6. Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016;138(1):16-27.
7. Saetta M, Turato G, Maestrelli P, Mapp CE, Fabbri LM. Cellular and structural bases of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;163:1304–1309.
8. White AJ, Gompertz S, Stockley RA. Chronic obstructive pulmonary disease 6: the aetiology of exacerbations of chronic obstructive pulmo- nary disease. Thorax 2003;58:73–80.
9. Bathoorn E, Liesker JJ, Postma DS, et al. Change in inflammation in out-patient COPD patients from stable phase to a subsequent exacerbation. Int J Chron Obstruct Pulmon Dis. 2009;4:101-109.
10. Mercer PF, Shute JK, Bhowmik A, et al. MMP-9, TIMP-1 and inflammatory cells in sputum from COPD patients during exacerbation. Respir Res. 2005;6:151.
11. Papi A, Bellettato CM, Braccioni F, et al. Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med. 2006;173:1114-1121.
12. Fiorini G, Crespi S, Rinaldi M, et al. Serum ECP and MPO are increased during exacerbations of chronic bronchitis with airway obstruction. Biomed Pharmacother 2000;54:274–8.
13. Saetta M, Di Stefano A, Maestrelli P, et al. Airway eosinophilia and expression of interleukin-5 protein in asthma and in exacerbations of chronic bronchitis. Clin Exp Allergy 1995;26:766–74.
14. Papi A, Romagnoli M, Baraldo S, et al. Partial reversibility of airflow limitation and increased exhaled NO and sputum eosinophilia in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2000;162:1773–7.
15. Rohde G, Gevaert P, Holtappels G, et al. Soluble interleukin-5 receptor alpha is increased in acute exacerbation of chronic obstructive pulmonary disease. Int Arch Allergy Immunol. 2004;135:54–61.
16. Hewson CA, Jardine A, Edwards MR, et al. Toll-like receptor 3 is induced by and mediates antiviral activity against rhinovirus infection of human bronchial epithelial cells. J Virol. 2005;79:12273–9.
17. Ritter M, Mennerich D, Weith A, et al. Characterization of Toll-like receptors in primary lung epithelial cells: strong impact of the TLR3 ligand poly(I:C) on the regulation of Toll-like receptors, adaptor proteins and inflammatory response. J Inflamm (Lond) 2005;2:16.
18. Fujimoto K, Yasuo M, Urushibata K, et al. Airway inflammation during stable and acutely exacerbated chronic obstructive pulmonary disease. Eur Respir J. 2005;25:640–6.
19. Zhu J, Qiu YS, Majumdar S, Gamble E, Matin D, Turato G, Fabbri LM, Barnes N, Saetta M, Jeffery PK. Exacerbations of bronchitis: bronchial eosinophilia and gene expression for interleukin-4, interleukin-5, and eosinophil chemoattractants. Am J Respir Crit Care Med 2001;164:109– 116.
20. Gompertz S, Stockley RA. Inflammation–role of the neutrophil and the eosinophil. Semin Respir Infect 2000;15:14–23.
21. Bocchino V, Bertorelli G, Bertrand CP, Ponath PD, Newman W, Franco C, Marruchella A, Merlini S, Del Donno M, Zhuo X, et al. Eotaxin and CCR3 are up-regulated in exacerbations of chronic bronchitis. Allergy 2002;57:17–22.
22. 78. Fujimoto K, Yasuo M, Urushibata K, Hanaoka M, Koizumi T, Kubo K. Airway inflammation during stable and acutely exacerbated chronic obstructive pulmonary disease. Eur Respir J 2005;25:640–646.
23. Brightling CE, McKenna S, Hargadon B, et al. Sputum eosinophilia and the short term response to inhaled mometasone in chronic obstructive pulmonary disease. Thorax. 2005;60:193–8.
24. StockleyRA,BayleyD,HillSL,HillAT,CrooksS,CampbellEJ.Assessment of airway neutrophils by sputum colour: correlation with airways inflammation. Thorax 2001;56:366–372.
25. Gompertz S, O’Brien C, Bayley D, et al. Changes in bronchial inflammation during acute exacerbations of chronic bronchitis. Eur Respir J 2001;17:1112–9.
26. Drost EM, Skwarski KM, Sauleda J, Soler N, Roca J, Agusti A, Macnee W. Oxidative stress and airway inflammation in severe exacerbations of COPD. Thorax 2005;60:293–300.
27. Papi A, Bellettato CM, Braccioni F, et al. Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med. 2006;173:1114–21.
28. Qiu Y, Zhu J, Bandi V, Atmar RL, Hattotuwa K, Guntupalli KK, Jeffery PK. Biopsy neutrophilia, neutrophil chemokine and receptor gene expression in severe exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2003;168:968–975.
29. Papi A, Bellettato CM, Braccioni F, et al. Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med. 2006;173:1114–21.
30. Sethi S, Wrona C, Eschberger K, et al. Inflammatory profile of new bacterial strain exacerbations of chronic obstructive pulmonary dis- ease. Am J Respir Crit Care Med. 2008;177:491-497.
31. Wilkinson TM, Hurst JR, Perera WR, et al. Effect of interactions between lower airway bacterial and rhinoviral infection in exacerba- tions of COPD. Chest. 2006;129:317-324.
32. Biernacki WA, Kharitonov SA, Barnes PJ. Increased leukotriene B4 and 8-isoprostane in exhaled breath condensate of patients with exacerbations of COPD. Thorax. 2003;58:294–8.
33. Furtmuller PG, Obinger C, Hsuanyu Y, et al. Mechanism of reaction of myeloperoxidase with hydrogen peroxide and chloride ion. Eur J Biochem. 2000;267:5858–64.
34. Aaron SD, Angel JB, Lunau M, et al. Granulocyte inflammatory markers and airway infection during acute exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2001;163:349–55.
35. Wedzicha JA, Seemungal TA, MacCallum PK, et al. Acute exacerbations of chronic obstructive pulmonary disease are accompanied by elevations of plasma fibrinogen and serum IL-6 levels. Thromb Haemost. 2000;84:210–15.
36. Wouters EF. Local and systemic inflammation in chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2005;2:26–33.