- Chi tiết
-
Được đăng: 21 Tháng 12 2015
Tóm tắt
Colistin là kháng sinh thuộc nhóm polymyxin được phát hiện vào cuối những năm 1940 với mục tiêu điều trị nhiễm trùng do vi khuẩn gram âm. Sau vài năm có mặt trên lâm sàng, Colistin dần được sử dụng ít hơn do nhiều báo cáo về độc tính thận và thần kinh quan trọng. Tuy nhiên gần đây, kháng sinh này đã trở lại với vai trò là lựa chọn điều trị cuối cùng đối với những vi khuẩn đa kháng như Pseudomonas aeruginosa, Acinetobacter baumannii, và Klebsiella pneumoniae. Do tỉ lệ mắc và tử vong cao liên quan những vi khuẩn gram âm này, nhu cầu đối với kháng sinh bao phủ được nhóm vi khuẩn này tăng lên đã khiến colistin trở thành lựa chọn điều trị quan trọng. Nhưng đáng buồn thay, sự đề kháng colistin đã được ghi nhận ở cả ba loại vi khuẩn trên trong những báo cáo trường hợp. Mặc dù cơ chế chính xác gây ra kháng colistin vẫn chưa được xác định, nhưng có giả thiết cho rằng hệ thống điều hòa gen PmrA-PmrB và PhoP-PhoQ đóng vai trò trong sự đề kháng colistin.
Bởi vì colistin là lựa chọn điều trị cuối cùng nên việc tối ưu hóa liều thuốc sử dụng là cần thiết; Hơn nữa, việc sử dụng những liều không tối ưu có thể làm gia tăng kháng thuốc. Tuy nhiên, việc thiếu những nghiên cứu về dược động - dược lực cũng như thiếu sự thống nhất đơn vị liều quốc tế gây khó khăn trong việc xác định cách cho liều tối ưu và hướng dẫn liều đặc hiệu cho colistin. Ở những bệnh nhân nặng như bệnh nhân suy đa cơ quan, bệnh nhân suy giảm chức năng thận thì dược động của colistin có thể bị thay đổi. Vì vậy, thay đổi liều ở những bệnh nhân này là bắt buộc, để có thể tối ưu hóa hiệu quả và giảm thiểu độc tính của colistin. Về độc tính colistin, hầu hết nghiên cứu cho thấy tác dụng độc thận là có thể phục hồi được và ít xảy hơn so với suy đoán trước đây, còn tác dụng độc thần kinh thì rất hiếm. Nghiên cứu thêm nữa là rất cần thiết để có thể hiểu được một cách toàn diện tác động của hai hệ thống điều hòa trên sự kháng thuốc, cũng như liều colistin phù hợp để ức chế và loại bỏ những kiểu kháng thuốc đang phát triển hiện nay.
Giới thiệu
Đề kháng kháng sinh đã trở thành cuộc khủng hoảng về chăm sóc sức khỏe toàn cầu, với nhiều tác nhân gây bệnh ít hoặc không còn nhạy cảm với những kháng sinh điều trị hiện tại. Nhiễm trùng gram âm thậm chí còn được quan tâm nhiều hơn bởi sự thiếu hụt những điều trị hiệu quả cũng như số lượng kháng sinh hạn chế trong điều trị những tác nhân gây bệnh chết người này.[1–5] Không có kháng sinh mới nào có thể chống lại vi khuẩn gram âm đa kháng được kỳ vọng ra đời trong vòng 5 năm tới. Điều này nhấn mạnh sự cần thiết của những lựa chọn điều trị cuối cùng chẳng hạn như colistin, đặc biệt ở những ca bệnh mà tác nhân gây bệnh đã kháng với tất cả kháng sinh khác.
Colistin, kháng sinh thuộc nhóm polymixin (polymyxin E), được phát hiện đầu tiên vào những năm 1940 nhưng mãi đến cuối những năm 1950 mới được đưa vào sử dụng. Trước đây, colistin đã được sử dụng chống lại nhiễm trùng gây ra bởi vi khuẩn gram âm khó trị. Tuy nhiên, những báo cáo về tác dụng độc thận và độc thần kinh đã ngăn cản các bác sĩ lâm sàng trong việc sử dụng kháng sinh này, đặc biệt với sự nổi lên của những loại kháng sinh khác ít độc hơn (như aminoglycosides...). Giữa những năm 1970 và 1990, colistin thường không được sử dụng và số lượng những nghiên cứu phân tích việc sử dụng cũng như dược lý của colistin là rất khan hiếm.
Gần đây, việc thiếu những chọn lựa điều trị đối với vi khuẩn đa kháng như Acinetobacter baumannii, Pseudomonas aeruginosa, và Klebsiella pneumoniae đã dẫn đến sự trỗi dậy của colistin với vai trò như một kháng sinh. Chính sự sử dụng không liên tục colistin trên lâm sàng qua các năm nên những dữ liệu về dược động và dược lực của nó rất giới hạn. Kiến thức về độc tính cũng như liều tối ưu của colistin vẫn chưa được xác định rõ ràng. Hơn nữa, những báo cáo ban đầu cho thấy sự đề kháng colistin bắt đầu xuất hiện ở những vi khuẩn đang được điều trị.[1, 2] Tốc độ kháng thuốc gia tăng nhấn mạnh nhu cầu hiểu biết về liều hiệu quả đầy đủ của colistin cùng với độc tính thấp nhất. Chúng tôi tiến hành tìm kiếm trên cơ sở dữ liệu MEDLINE những bài báo được xuất bản từ năm 1945 đến tháng 5 năm 2010 để xem xét dược tính, tính kháng thuốc, độc tính, dược lực cũng như xác định liều lượng sử dụng của colistin.
Dạng sử dụng, thải trừ thuốc, cơ chế tác dụng và phổ kháng khuẩn
Colistin sẵn sàng ở hai dạng sử dụng colistin sulfate dùng tại chỗ và colistimethate natri dùng toàn thân tương ứng cho việc sử dụng tại chổ hay đường tĩnh mạch. Cả hai dạng đều có thể dùng đường hít. Điều quan trọng cần lưu ý là hai dạng này không thể thay thế lẫn nhau. Colistin sulfate tích điện dương và ổn định, trong khi colistimethate natri tích điện âm và không ổn định cả trong thực nghiệm lẫn trong cơ thể.[6, 7] Colistimethate natri là dạng an toàn hơn để sử dụng đường tĩnh mạch vì tần suấtgây độc thấp hơn.[8] Vì là dạng tiền thuốc, colistimethate natri dễ dàng bị thủy phân để tạo nên những dẫn xuất sulfomethylate không hoàn chỉnh, giống như colistin sulfate một dạng hoạt động của thuốc.[8] Sự thủy phân colistimethate natri thành colistin này là một bước quan trọng trong hoạt tính kháng khuẩn của thuốc. Trước khi colistin được tạo thành, colistimethate natri có rất ít đến không có hoạt tính kháng khuẩn và được xem là dạng bất hoạt của colistin.[8]
Colistimethate natri bị thải trừ chủ yếu tại thận, một phần thuốc sẽ được biến đổi để thành colistin có hoạt tính trong cơ thể. Colistin được tái hấp thu tích cực tại ống thận và vì vậy được lọc bởi những cơ chế không thận khác.[9, 10] Cơ chế đằng sau khả năng diệt khuẩn của colistin được cho là rất giống với cơ chế của polymyxin B, một đại diện của nhóm polymyxin.[11] Colistin mang nhiều điện tích dương, vừa ái nước vừa ái mỡ. Những điện tích dương này tương tác theo cơ chế cân bằng điện tích với lớp màng ngoài của vi khuẩn gram âm và thế chỗ cho những ion mang hai điện tích dương của lớp màng lipid, đặc biệt là Calci và Magie.[12] Điều này phá vỡ lớp màng ngoài và giải phóng lipopolysaccharide.[13] Sự thay đổi tính thấm của màng tế bào vi khuẩn dẫn đến sự rò rỉ thành phần trong tế bào và sau đó là sự ly giải tế bào, dẫn đến sự chết tế bào.[2–4] Colistin cũng có khả năng gắn kết và trung hòa phân tử lipopolysaccharide của vi khuẩn, đây chính là hoạt tính kháng nội độc tố của thuốc.[2] Colistin có phổ kháng khuẩn hẹp mà hầu như chỉ nhạy với các vi khuẩn gram âm thường gặp. Đặc biệt nhất là colistin có thể chống lại những vi khuẩn gram âm đa kháng như A. baumannii, P.aeruginosa, và K. pneumoniae trong điều kiện thực nghiệm. Colistin cũng có hoạt tính chống lại những vi khuẩn khác như Enterobacteriaceae, Stenotrophomonas maltophilia, Escherichia coli, Salmonella species, Shigella species, Haemophilus influenzae, Bordetella pertussis, và Legionella pneumophila.[2]
Những báo cáo liên quan kháng Colistin
Như đã đề cập, ở những vi khuẩn đa kháng như A. baumannii, P.aeruginosa, và K. pneumoniae, sự cần thiết của những điều trị thay thế đã dẫn đến sự trở lại của colistin. Mặc dù colistin cho thấy hiệu quả trong điều trị nhiều loại nhiễm trùng khác nhau[3, 14] nhưng việc sử dụng colistin nhằm điều trị nhiễm trùng gây ra do ba tác nhân trên bị cản trở bởi sự xuất hiện của tình trạng kháng thuốc. Sự gia tăng kháng thuốc này là một vấn đề rất đáng ngại. Bởi vì colistin là lựa chọn điều trị cuối cùng đối với những tác nhân gây bệnh này, việc kháng thuốc có thể rất nguy hiểm nếu không còn lựa chọn điều trị nào khác. Những trường hợp kháng colistin, cũng như những cơ chế đằng sau sự gia tăng kháng thuốc này sẽ được bàn luận ở những phần sau.
Acinetobacter baumannii
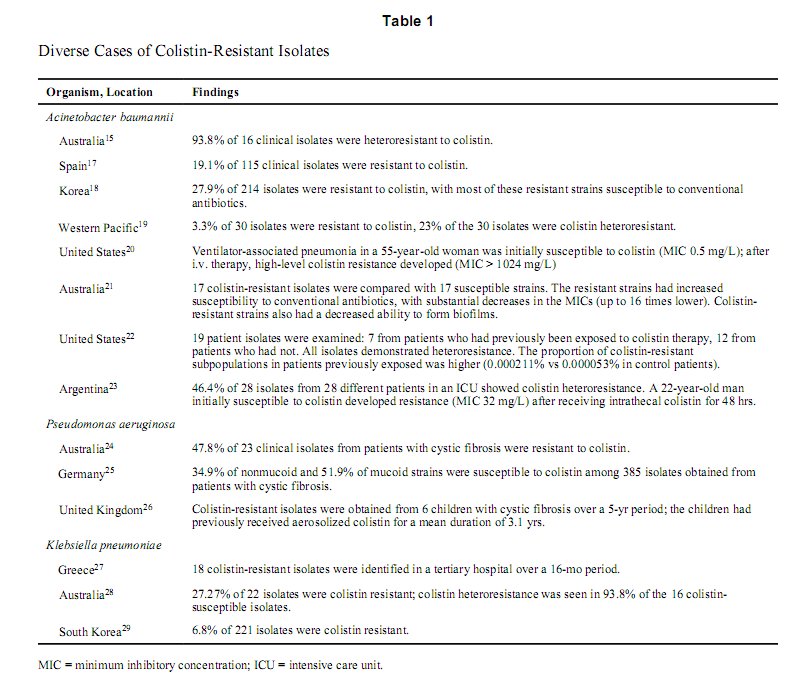
Sự gia tăng tần suất nhiễm đi đôi với tình trạng kháng thuốc ngày càng gia tăng của A. baumannii, cũng như việc thiếu hụt thuốc chống lại nó đã khiến loại vi khuẩn này trở thành một trong những vi khuẩn gram âm khó điều trị và khó kiểm soát nhất.[1, 15] Theo Hiệp Hội Chuẩn Hóa Về Xét Nghiệm và Lâm Sàng (CLSI), ngưỡng nhạy cảm của A. baumannii≤ 2 mg/Lvà ngưỡng kháng thuốc ≥ 8 mg/L.[16] Mặc dù colistin được xem là loại thuốc đáng tin cậy trong điều trị A. baumannii nhưng nhữngbáo cáo về chủng kháng thuốc ngày càng gia tăng.[17–20] Những nghiên cứu gần đây đã cho thấy những tỉ lệ kháng thuốc khác nhau cũng như sự xuất hiện của những chủng dị kháng (Table 1).[15, 17–29]
Trong một nghiên cứu với 265 chủng Acinetobacter được thu thập từ hai bệnh viện tại Hàn Quốc[18] có 214 mẫu (81%) được xác định là A.baumannii. Bằng phương pháp pha loãng vi khuẩn trong nước luộc thịt, 27.9% mẫu phân lập được phát hiện kháng với colistin (nồng độ ức chế tối thiểu [MIC] > 16 mg/L) với nồng độ thuốc tối thiểu có thể ức chế được 90% vi khuẩn (MIC90) là 32 mg/L. Những chủng A. baumannii này tiếp tục được xếp vào ba nhóm nhỏ hơn, dựa trên phân nhóm phát sinh loài. Ở phân nhóm II và III, hầu hết các mẫu đều kháng colistin (64.8% và 88.9% theo thứ tự) nhưng vẫn nhạy với những kháng sinh truyền thống khác (như carbapenems, β-lactams, và ciprofloxacin). Trong khi đó, những mẫu A. baumannii ở phân nhóm I có tỉ lệ kháng colistin thấp hơn (7%), nhưng lại tăng kháng với những kháng sinh này.
Nghiên cứu thứ hai tiến hành so sánh 17 mẫu kháng colistin của A. baumannii phân lập được với 17 chủng nhạy thuốc cũng cho những kết quả tương tự.[21] Giống như nghiên cứu trước, nghiên cứu này cũng sử dụng phương pháp hòa tan vi khuẩn trong nước luộc thịt để tìm MICs. Nhìn chung, những chủng kháng colistin đã gia tăng độ nhạy với những kháng sinh truyền thống, biểu hiện bằng MICs đã giảm (thấp hơn 16 lần). Những chủng kháng colistin cũng được phát hiện giảm khả năng hình thành biofilm, điều này liên quan đến việc giảm ngưỡng nhạy cảm với kháng sinh ở các A. baumannii này.[21]
Trong nhiều nghiên cứu, colistin cũng biểu lộ tính dị kháng.[15, 19, 22, 23] Sự dị kháng xảy ra khi một nhóm trong cùng một chủng giảm nhạy với thuốc, mặc dù MIC toàn thể thì không đổi. Điều này cho thấy không thể sử dụng một mình MIC để phát hiện những nhóm kháng thuốc. Trong một nghiên cứu trên 16 mẫu A. baumannii phân lập được, tất cả đều hoàn toàn nhạy với colistin, với MIC nhỏ hơn hay bằng 2 mg/L.[15] Tuy nhiên, khi sử dụng colistin ở nồng độ tăng lên 32 lần MIC, A.baumannii đã phát triển trở lại một cách có ý nghĩa tại thời điểm 24 giờ. Nghiên cứu cho thấy có 15 trong số 16 mẫu đã biểu lộ tính dị kháng. Những kết quả tương tự cũng được ghi nhận ở những nghiên cứu khác với sự phát triển trở lại của chủng dị kháng trong vòng 6 giờ bất kể thời gian liều khởi đầu.[30–32]
Một nghiên cứu gần đây về những mẫu được lấy ở vùng Tây Thái Bình Dương đã cho thấy có 1 trên 30 mẫu kháng với colistin (3.3%) và 7 mẫu dị kháng colistin (23%).[19] Mặc dù tỉ lệ kháng và dị kháng colistin thấp hơn so với những báo cáo trước đây, nhưng những kết quả này nhấn mạnh rằng không chỉ đòi hỏi sử dụng đủ liều mà còn chú ý đến việc phối hợp kháng sinh nhằm tiệt trừ những nhóm kháng thuốc này.
Pseudomonas aeruginosa
Tỉ lệ tử vong cao liên quan nhiễm P.aeruginosa do nhiều cơ chế kháng thuốc, với một số mẫu phân lập được đã cho thấy sự đề kháng với tất cả những kháng sinh được chấp thuận bởi FDA của Hoa Kỳ.[1] Ngưỡng nhạy cảm theo CLSI là ≤ 2 mg/L và ngưỡng kháng thuốc ≥ 4 mg/L.Tình trạng nhiễm trùng và kháng thuốc do P. aeruginosa thậm chí còn đáng lo ngại hơn ở những bệnh nhân mắc bệnh xơ nang, bởi vì đây là tác nhân gây bệnh thường định cư ở phổi với tỉ lệ kháng thuốc rất cao.[25] Trong khi colistin thường được xem là liệu pháp cứu nguy và đôi khi là lựa chọn duy nhất để chống lại P. aeruginosa, thì tình trạng kháng colistin lại đang có chiều hướng gia tăng (Table 1).
Trong 385 chủng P. aeruginosa phân lập được từ 57 người trưởng thành mắc bệnh xơ nang, chỉ có 34.9% chủng không tiết nhầy và 51.9% chủng tiết nhầy nhạy với colistin (MIC < 0.5 mg/L).[25] Hơn nữa, mô hình phân bố MIC trong nghiên cứu này đã cho thấy sự hiện diện của hai nhóm dân số MICs, đây có thể là dấu hiệu của tình trạng kháng thuốc mới nổi.
Một nghiên cứu thứ hai tiến hành trên 23 mẫu phân lập từ những bệnh nhân mắc bệnh xơ nang cho thấy có 11 chủng kháng với colistin với MICs tăng đến 128 mg/L.[24] Những trường hợp kháng colistin cũng đã được ghi nhận ở 6 bệnh nhi mắc bệnh xơ nang sau khi được điều trị bằng colistin dạng khí dung trong khoảng thời gian trung bình là 3.1 năm.[26] Sự gia tăng tình trạng kháng colistin của P. aeruginosa đã bắt đầu nổi lên trong dân số bệnh nhân mắc xơ nang, điều này có thể là hậu quả của việc sử dụng tràn lan colistin dạng hít ở những bệnh nhân này. Tình trạng kháng thuốc nếu tiếp tục gia tăng sẽ rất nguy hại bởi P. aeruginosa đóng vai trò rất lớn trong sự hủy hoại phổi và tình trạng suy hô hấp ở những bệnh nhân xơ nang.
Klebsiella pneumoniae
Nhu cầu về kháng sinh thay thế trong điều trị K. pneumoniae ngày càng gia tăng cùng với sự gia tăng của men K. pneumoniae carbapenemases, men β-lactamase phổ rộng (ESBL) và men metallo-β-lactamase (MBL) sản sinh ra từ những dòng khác nhau của loại vi khuẩn này. Mặc dù những báo cáo về kháng colistin của nhóm tác nhân này vẫn còn thưa thớt nhưng chúng vẫn rất có ý nghĩa, bởi những lựa chọn điều trị hiện tại và trong tương lai đối với K.pneumoniae sinh ESBL và MBL rất hạn chế.
Trong một nghiên cứu tiến hành trên 18 mẫu phân lập được K. pneumoniae kháng colistin (MIC > 8 mg/L) từ 13 bệnh nhân trong hơn 16 tháng tại một trung tâm chăm sóc đặc biệt ở Hy Lạp.[27] Tất cả những bệnh nhân này đều có thời gian sử dụng colistin (trung bình 27 ngày) và nhập viện điều trị (69 ngày) kéo dài, điều này có thể đóng góp vào việc gia tăng kháng thuốc. Gần đây nhất, 6.8% (15 trong số 221 mẫu phân lập)[29] và 27.3% (6 trong số 22 mẫu phân lập)[28] mẫu K. pneumoniae phân lập được đã cho thấy kháng colistin lần lượt tại miền nam Hàn Quốc và Australia.
Cơ chế gây kháng thuốc
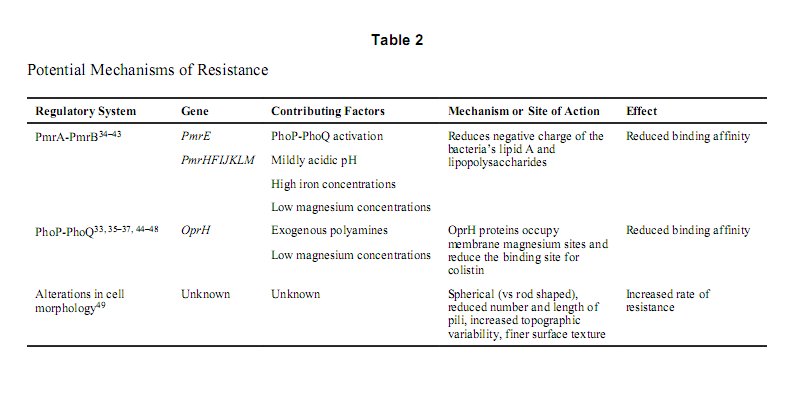
Đề kháng colistin có thể xuất hiện bởi cơ chế thích nghi hoặc đột biến và hầu hết có sự đề kháng chéo giữa colistin và những polymyxin khác.[4] Sự đa dạng trong biến đổi gen nhằm thay đổi lớp màng ngoài của vi khuẩn gram âm, vốn là vị trí hoạt động của colistin đã dẫn đến sự kháng thuốc. Mặc dù dữ liệu về cơ chế gây kháng thuốc này còn rất ít và dường như còn tùy thuộc từng vi khuẩn nhưng hệ thống điều hòa gen PmrA-PmrB và PhoP-PhoQ cho thấy đóng vai trò quan trọng trong sự gia tăng kháng thuốc này (Table 2).[33–49] Những hệ thống điều hòa gồm hai thành phần như PmrA-PmrB và PhoP-PhoQ, cho phép vi khuẩn đáp ứng với những thay đổi của môi trường bằng cách biến đổi một số gen biểu hiện. Khi những hệ thống điều hòa này tương tác lẫn nhau, chúng được cho là gây ra những thay đổi đa dạng hơn.[33]
Một cơ chế kháng thuốc khác được cho thấy là liên quan với thay đổi cấu trúc của lớp lipid A và lipopolysaccharides tích điện âm trên bề mặt của vi khuẩn. Sự thay đổi này là kết quả của sự hoạt hóa hệ thống PmrA-PmrB. Hệ thống này được điều hòa bởi hệ thống PhoP-PhoQ, nhưng cũng có thể hoạt động độc lập trong môi trường axit nhẹ hoặc nồng độ sắt cao.[34, 35] Hệ thống PmrA-PmrB điều hòa hai điểm PmrE and PmrHFIJKLM, chịu trách nhiệm trong việc thay đổi lipid A và đóng vai trò quan trọng trong cơ chế kháng polymyxin.[34, 36–40] Khi được hoạt hóa, hệ thống PmrA-PmrB sẽ gắn thêm ethanolamine vào nhóm phosphate của lipopolysaccharides và lipid A, đồng thời cũng chèn thêm aminoarabinose tại vị trí 4' phosphate của lipid A.[34, 35, 41, 42] Sự thay đổi này sẽ làm giảm tổng điện tích của lipopolysaccharide và vì vậy sẽ làm giảm ái lực gắn kết với những polymyxin mang điện tích dương.[43]
Nồng độ magie và pH của môi trường là hai nhân tố chính cho thấy tác động lên sự biểu hiện gen và sự xuất hiện kháng thuốc của vi khuẩn. Một nghiên cứu về sự phát triển của Salmonella enterica trong điều kiện 10 mM magnesium chloride ở pH 5.8 đã cho thấy kháng polymyxin B tăng lên xấp xỉ 100,000 lần so với những chủng được phát triển ở pH 7.7.[41] Sự gia tăng này được cho là do sự tăng hoạt động của hệ thống PmrA-PmrB ở môi trường pH acid nhẹ và nồng độ magnesium vi phân tử. Điều này có thể được dùng để theo dõi hoặc chỉnh sửa nồng độ pH và magnesium giúp ngăn chặn sự kháng thuốc do những yếu tố này gây ra. Tuy nhiên, chúng ta cần thêm nhiều thông tin hơn nữa trước khi có thể xác định chắc chắn. Những nghiên cứu kiểm tra mối liên quan giữa nồng độ pH cũng như magnesium trong môi trường với tỉ lệ kháng thuốc còn giới hạn, do đó vẫn chưa xác định được những bước đi cụ thể mà nhà lâm sàng cần tiến hành. Tuy nhiên, rõ ràng cần tác động pH và magnesium để hệ thống PmrA-PmrB hoạt động. Giả thiết về đột biến PmrA cho thấy sự thất bại trong việc lý giải sự đề kháng polymyxin.[44]
Nồng độ magie thấp cũng gây gia tăng kháng thuốc do sự hoạt hóa PhoP và PmrA. Sự hoạt hóa này không chỉ làm thay đổi lipopolysaccharides của vi khuẩn mà còn làm gia tăng biểu hiện của gen OprH, đóng vai trò là yếu tố chính trong việc phát triển tình trạng kháng thuốc.[33, 35, 37, 44] Gen OprH, PhoP và PhoQ tạo thành một “operon” kiểm soát cả PhoP và nồng độ magnesium cũng như góp phần vào sự đề kháng polymyxin.[35, 45] Gen OprH nằm ngay dưới hệ thống điều hòa PhoP-PhoQ, mã hóa cho một protein màng ngoài được gọi là OprH, đây là protein gia tăng biểu hiện trong điều kiện nồng độ magnesium thấp.[36] Những protein này chiếm giữ những vị trí magnesium trên màng tế bào và làm giảm những vị trí gắn kết của colistin gây nên tình trạng kháng thuốc.[35, 45–47]
Sự hiện diện của nhiều axit amine ngoại sinh (spermidine, spermine, putrescine, và cadaverine) cho thấy cũng gây hoạt hóa OprH-PhoP-PhoQ operon, dẫn đến sự gia tăng MICs không chỉ của các polymyxin mà còn của aminoglycosides, quinolones, và những thuốc nhuộm huỳnh quang chống lại P.aeruginosa bất kể nồng độ ion dương.[48] Mặc dù OprH được cho là đóng vai trò trong sự kháng thuốc nhưng cũng có bằng chứng cho thấy kháng thuốc vẫn xảy ra mà không cần sự hiện diện của OprH, bởi một số chủng P. aeruginosa thiếu OprH vẫn có thể kháng polymxin.[33] Tương tự như vậy, một số nghiên cứu cho thấy mặc dù PhoP cần thiết cho việc sao chép của OprH-PhoP-PhoQ operon nhưng những chủng P. aeruginosa không có PhoP vẫn kháng polymyxin.[45] Điều này rất có ý nghĩa bởi nó minh chứng cho vai trò độc lập của hệ thống PmrA-PmrB trong sự đề kháng polymyxin cũng như những cơ chế tiềm năng chưa được xác định khác gây ra sự kháng thuốc.
Gần đây, hình thái học và cấu trúc tế bào của những vi khuẩn kháng colistin được phát hiện là rất khác so với hình thái học và cấu trúc của những tế bào nhạy cảm colistin. Điều này mang đến cho chúng ta nhận thức sâu hơn về những cơ chế dẫn đến sự đề kháng colistin.[49] Một nghiên cứu dựa trên kính hiển vi lực nguyên tử được thực hiện ở những chủng kháng colistin và cả chủng nhạy colistin ở những giai đoạn sinh trưởng khác nhau.[49] So với những tế bào vi khuẩn kháng colistin có hình cầu ở giai đoạn tăng sinh (theo hàm logarit) sớm và giữa, những tế bào nhạy thuốc được phát hiện lại có hình que, với sự hiện diện của tiêm mao ở tất cả các giai đoạn. Số lượng và độ dài của tiêm mao ở những tế bào vi khuẩn kháng colistin giảm nhiều và đây có thể là lý do việc những tế bào này kháng colistin liên quan đến việc chúng không có khả năng tạo được biofilm. Hơn nữa, những tế bào kháng colistin thì đa dạng về cấu trúc hơn cũng như có kết cấu bề mặt trơn láng hơn. Trong giai đoạn ổn định, những tế bào như những con giun kéo dài được bắt gặp nhiều hơn ở nhóm nhạy thuốc, trong khi đó nhóm kháng thuốc lại cho thấy những tế bào hỗn tạp hơn trong giai đoạn này. Điều thú vị là mức độ hủy hoại màng ngoài vi khuẩn sau điều trị bằng colistin là tương tự ở cả tế bào nhạy và kháng thuốc, điều này cho thấy khả năng những tế bào kháng colistin vẫn duy trì sự tương tác với lớp màng ngoài.[21, 49] Những phát hiện này đã minh chứng rằng những nghiên cứu chuyên biệt nhằm xem xét những cơ chế gen đằng sau sự khác biệt về hình thái học và cấu trúc tế bào rất cần được thực hiện, để qua đó ta có thể hiểu được nhiều hơn về sự đề kháng đối với colistin.
Độc tính
Trong thời kỳ đầu sử dụng colistin, đã có nhiều báo cáo liên quan độc tính thận và thần kinh.[2] Chính vì thế Colistin đã bị đình chỉ sử dụng một thời gian ngắn sau đó.[2–4, 50–52] Tuy nhiên, các báo cáo 10 năm qua cho thấy độc tính của nó ít hơn nhiều so với trước đây.[5, 50, 53–56] Những báo cáo độc tính trước đây thường cho thấy thiếu những nghiên cứu cụ thể liên quan dược động, dược lực và độc tính.[2] Thêm vào đó là việc sử dụng sai liều lượng (do sự nhầm lẫn giữa dạng liều sử dụng và hàm lượng thật sự), sử dùng đồng thời thuốc độc thận khác cũng như sử dụng thuốc trên cơ địa có sẵn bệnh lý thận cũng góp phần gây ra độc tính này.[57] Từ đó, một vài nghiên cứu đánh giá tính an toàn của colistin đã được tiến hành và kết quả từ những nghiên cứu này cho chúng tôi một sự đánh giá đúng đắn hơn về độc tính kháng sinh này. (Bảng 3).[51, 53–56, 58–62]
Độc tính lên thận
Một vài nghiên cứu đã chứng minh được tính an toàn chấp nhận được khi dùng colistimethate natri đường tĩnh mạch với liều 160 mg x 3 lần/ngày ở bệnh nhân với chức năng thận bình thường.[58, 63, 64] Các tác giả trong hai nghiên cứu này cho thấy không có tác dụng phụ nghiêm trọng nào xuất hiện ở nhóm bệnh nhân xơ nang phổi cũng như không có sự thay đổi đáng kể nào về chức năng thận với liều sử dụng này.[58, 63] Hơn thế nữa, colistin gần đây cho thấy tác dụng phụ nhẹ nhàng hơn nhóm aminoglycoside (nhóm thuốc trước đây được sử dụng thay cho colistin do suy nghĩ chúng ít độc hơn).[55, 65] Riêng có một nhóm tác giả khác tìm thấy nhóm aminoglycoside gây ra sự suy giảm chức năng thận và điều này sẽ nặng hơn khi sử dụng kết hợp với colistin.[55] Tuy nhiên, colistin đơn đôc hay phối hợp với kháng sinh độc thận không thật sự đưa đến sự phá hủy thận. Hai nghiên cứu thêm nữa cũng kết luận rằng colistin dung nạp tốt ở những bệnh nhân nặng.[53, 59] Trong đó có một nghiên cứu[59] chỉ ra có sự gia tăng creatinine nhẹ khoảng 0.25 mg/dl so với nền trong quá trình điều trị, tuy nhiên cần lưu ý rằng nghiên cứu này được tiến hành trên nhóm bệnh nhân có chức năng thận suy giảm trước đó. Mặc dù gia tăng creatinine là một mối lo ngại nhưng không có tác dụng phụ nghiêm trọng thật sự cũng như không có một dữ liệu nào chỉ ra độc tính trực tiếp lên thận.
Mặc dù độc tính lên thận của colistin thật sự không giống như suy nghĩ ban đầu nhưng nó vẫn là một tác dụng phụ cần lưu ý khi dùng kháng sinh này. Một số ít những nghiên cứu gần đây đưa cho chúng tôi cái nhìn sâu hơn về vấn đề suy giảm chức năng thận gây ra do colistin. Một nhóm tác giả đánh giá sự xuất hiện suy thận cấp (dựa vào tiêu chuẩn RIFLE: nguy cơ độc thận, tổn thương thận, suy thận, mất chức năng thận và bệnh thận giai đoạn cuối) dựa trên việc xem xét những bệnh nhân (>18 tuổi) điều trị với colistimethate natri đường tĩnh mạch (> 72 giờ) trong khoảng thời gian từ tháng 1 năm 2003 đến tháng 12 năm 2007.[60] Với 66 bệnh nhân, các tác giả này tìm thấy nồng độ đỉnh creatinine khi điều trị với colistimethate natri thỏa tiêu chuẩn RIFLE về độc thận trong 45% trường hợp và trong đó có đến 21% trường hợp phải ngưng sử dụng colistin. Khả năng độc thận gia tăng tỷ lệ với toàn bộ tổng liều colistimethate natri sử dụng và nguy cơ xuất hiện độc thận tăng gấp 3.7 lần trong những trường hợp điều trị kéo dài > 14 ngày. Điều này cũng phù hợp với một nghiên cứu đoàn hệ tiền cứu khác, trong đó các tác giả tìm thấy biến đổi nồng độ creatinine tương quan với liều tích tụ của colistimethate natri được dùng.[61] Tương tự nghiên cứu đầu tiên được đề cặp, creatinine huyết thanh trở về mức nền trong vòng 1 tháng sau khi ngưng colistin[60] (điều này cho thấy sự hồi phục thận bị tổn thương sau khi ngưng thuốc). Một nhóm tác giả thứ ba thực hiện một nghiên cứu bệnh chứng nhằm đánh giá sự xuất hiện độc tính ở thận kết hợp với phân tích các đặc điểm và những yếu tố nguy cơ xuất hiện độc tính này. Tác giả tìm thấy giảm albumin máu và việc sử dụng đồng thời với NSAID là hai yếu tố nguy cơ độc lập duy nhất có ý nghĩa liên quan xuất hiện độc tính thận.
Độc tính thần kinh
Những tác dụng phụ lên thần kinh bao gồm dị cảm, thay đổi thị giác, rối loạn phối hợp vận động và ức chế dẫn truyền thần kinh cơ đều có thể xảy ra với nhóm kháng sinh polymyxin. Tuy nhiên, những tác dụng này thường biến mất sau khi ngưng thuốc và thường xuất hiện trên những bệnh nhân điều trị kéo dài. Những trường hợp biểu hiện độc tính thần kinh thường nhẹ và tần xuất xảy ra hiếm chỉ khoảng 0-7%.[66] Rất hiếm những dữ liệu liên quan độc tính thần kinh do colistin khi nó được sử dụng đơn độc. Một nghiên cứu ở 21 bệnh nhân viêm phổi liên quan thở máy điều trị với colistin cho thấy không có hiện diện của sự ức chế dẫn truyền thần kinh cũng như bệnh lý đa dây thần kinh nặng ở những bệnh nhân này dựa trên kỹ thuật xét nghiệm điện sinh lý.[67] Nghiên cứu kết luận colistin là một điều trị thay thế an toàn. Một nghiên cứu khác trên 17 bệnh nhân điều trị với colistin hơn 4 tuần, trong đó tìm thấy 1 bệnh nhân xuất hiện bệnh lý thần kinh được tin là do colistin.[59] Mặc dù vậy, các tác giả nghiên cứu cũng kết luận colistin là một điều trị thay thế tương đối hiệu quả và an toàn.
Tóm lại
Độc tính khi sử dụng colistin liên quan với lượng colistimethate natri tích lũy toàn bộ hơn là với liều đơn độc hay liều cụ thể hằng ngày. Và nó sẽ xuất hiện thường hơn ở những bệnh nhân giảm albumin máu hay có sử dụng đồng thời với NSAID. Xem xét cẩn thận các yếu tố này khi tính liều giúp phòng ngừa các tác dụng phụ có thể. Mặc dù một số nghiên cứu gần đây cho thấy sự liên quan giữa gia tăng mức creatinine với sử dụng colistin nhưng tác dụng này thường biến mất khi ngưng thuốc. Kết luận từ nhiều nghiên cứu cho thấy colistin thường được dung nạp tốt, ít độc thận và thần kinh hơn so với nhận định trước đây.
Tối ưu hóa liều colistin sử dụng
Thiếu sự thống nhất đơn vị liều
Chúng tôi xin giới thiệu đến bạn đọc một số bài báo liên quan về vấn đề thiếu sự thống nhất đơn vị liều colistin trong hiện tại.[2, 5, 68] Thiếu dữ liệu về dược động và dược lực tạo ra nhiều sự nhầm lẫn trong việc xác định liều tối ưu của colistin (liều với hiệu quả tối đa và tác dụng phụ tối thiểu).[2, 5] Trước khi cố gắng xác định liều tối ưu của colistin, một đơn vị đo lường thống nhất về liều lượng là cần thiết để đánh giá đúng lượng thuốc đang được sử dụng. Sự không rõ ràng trong liều lượng colistin là do một vài sản phẩm trình bày dạng miligrams trong khi những cái khác sử dụng đơn vị UI. Về việc chuyển đổi giữa mg và UI, có một sự tương đương giữa 12500 UI với 1 mg colistimethate natri.[5] Một ví dụ cho sự chuyển đổi này: một liều trung bình colistimethate natri 2 triệu UI tương ứng với 160 mg thuốc này.
Một rắc rối khác là một vài sản phẩm lại tính mg dựa vào “colistin nền hoạt động” chứ không phải mg của colistimethate natri. Cần nhấn mạnh một điều là colistimethate natri và colistin nền không tương đồng, đặc biệt là khi xác định liều lượng. Khoảng 2.67 mg colistimethate natri tương ứng với 1 mg colisin nền.[5] Cũng từ ví dụ ở trên, 2 triệu UI hay 160 mg colistimethate natri sẽ cho tương ứng với 60 mg colistin nền. Từ những vấn đề phức tạp này, việc thống nhất một dạng sử dụng và đơn vị liều lượng sẽ tạo thuận lợi rất nhiều trong việc thảo luận liều lượng tối ưu của colistin.
Sự khác nhau giữa liều sử dụng được khuyến cáo
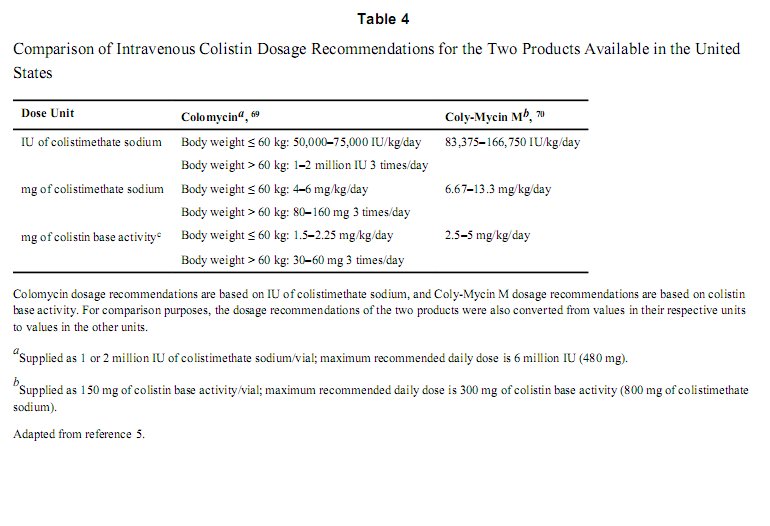
Một khi dạng sử dụng và đơn vị liều lượng được thống nhất, liều lượng tối ưu cho bệnh nhân sẽ cần được xác định. Do colistin là một thuốc cổ xưa nên có rất ít những thông tin liên quan dược động, dược lực và độc tính để giúp cho việc xác định liều hiệu quả và an toàn. Do đó, liều hiện tại sử dụng chủ yếu dựa vào những hướng dẫn của các nhà sản xuất. Nhà sản xuất Colomycin (công ty dược Xellia, Copenhagen, Đan Mạch) khuyến cáo đối với những bệnh nhân trên 60 kg nên nhận liều 1-2 triệu UI x 3 lần/ ngày tương đương với colistimethate natri 80-160 mg x 3 lần/ngày, tổng liều hằng ngày không quá 6 triệu UI tương đương với 480 mg colistimethate.[69] Nhà sản xuất Coly-Mycin M (Công ty dược Parkedale, Inc., Rchester, MN) khuyến cáo liều 2.5-5 mg/kg/ngày chia 2-4 lần/ngày tương đương với colistimethate natri 6.67-13.3 mg/kg/ngày hay 83375-166250 UI/kg/ngày.[70] Với liều tối đa hằng ngày 10 triệu UI hay 800 mg colistimethate natri, đây là liều gấp đôi so với liều được khuyến cáo từ nhà sản xuất Colomycin. Bảng 4 cung cấp thêm thông tin so sánh giữa 2 sản phẩm.
Liều lượng thuốc khuyến cáo bởi nhà sản xuất Coly-Mycin M cho thấy gấp đôi so với nhà sản xuất Colomycin. Thiếu sự thống nhất giữa các nhà sản xuất có thể dẫn đến việc sử dụng liều không đủ và hiển nhiên sẽ dẫn đến thất bại điều trị và kháng thuốc.[68] Nhiều thông tin hơn cần có trước khi chúng ta kết luận về liều cho kết quả tốt nhất với độ an toàn chấp nhận được.
Ứng dụng dược lực học giúp xác định liều tối ưu
Để chọn lựa được liều colistimethate và colistin tối ưu thì điều quan trọng cần nắm được dược lực của nó. Colistin là một kháng sinh kháng khuẩn nhanh cùng với việc sở hữu tác dụng hậu kháng sinh có ý nghĩa đối với các tác nhân như P. aeruginosa, A. baumannii và K. pneumoniae.[24] Diện tích nồng độ colistin dưới đường cong (AUC:MIC) được tìm thấy là một thông số liên quan tốt nhất với hiệu quả kháng sinh.[71, 72] Những nhà nghiên cứu sử dụng mô hình nhiễm trùng ở phổi và nhiễm trùng ở đùi của chuột giảm bạch cầu để xác định chỉ số dược động - dược lực, cái mà liên quan tốt nhất với tác dụng kháng P.aeruginosa của colistin và đồng thời xác định trị số chỉ điểm đích cho từng hoạt tính kháng vi trùng cụ thể.[71] Trong cả hai mô hình, tỷ số AUC:MIC (fAUC:MIC) riêng lẻ là chỉ điểm dược động-dược lực cho thấy liên quan mạnh mẽ nhất với tải lượng vi trùng với giá trị R2 tương ứng từng mô hình 87% và 89%. Thời gian nồng độ thuốc tự do trên MIC cũng cho thấy liên quan mật thiết với hiệu quả kháng vi trùng với giá trị R2 tương ứng 84% và 88% ở mô hình thử nghiệm đùi và phổi tương ứng. Tuy nhiên những nhà nghiên cứu cũng nhấn mạnh tỷ số AUC:MIC (tích phân) vẫn là chỉ điểm dược động - dược lực tương quan tốt nhất với hoạt tính của colistin bởi vì biểu đồ phân tán T>MIC thay đổi rộng trong khoảng 20-30% và hoạt tính giết vi trùng phụ thuộc vào nồng độ đã đươc xác lập trên thử nghiệm. Trong mô hình phổi nhiễm trùng, khoảng tỷ số đích AUC:MIC theo 3 dòng vi khuẩn khác nhau là 15.6-22.7, 27.6-36.1 và 53.3-66.7 sẽ giết được vi trùng với sự giảm nồng độ tương ứng 1-log, 2-log và 3-log. Còn đối với mô hình nhiễm trùng vùng đùi, khoảng tỷ số này thay đổi từ 12.2-16.7, 36.9-45.9 và 105-141 tương ứng với sự giết vi trùng được 1-log, 2-log và 3-log. Mặc dù có sự tương đồng về dược lực trong 2 mô hình nhiễm trùng, một số khác biệt được tìm thấy nhấn mạnh việc cần điều chỉnh liều đối với từng vị trí và loại nhiễm trùng một cách thích hợp.
Đặc biệt trong nhiễm trùng nặng như viêm nội tâm mạc nhiễm trùng, nhiễm trùng dụng cụ giả và viêm phổi liên quan thở máy, nồng độ vi trùng gây bệnh thường khá cao có thể tác động đến dược lực của colistin.[73] Gần đây, hoạt tính kháng khuẩn colistin cho thấy sẽ bị suy giảm khi gặp nồng độ vi khuẩn cao. Những nhà nghiên cứu tìm thấy mức độ diệt vi trùng sẽ giảm nhiều khi liều lượng vi trùng cao trong khi nồng độ thuốc lại thấp.[73] Đối với tác nhân P. aeruginosa (kiểu gen PAO1), hoạt tính giết vi trùng của colistin thấp hơn 23 lần tại nồng độ vi trùng 109 và thấp hơn 6 lần tại nồng độ vi trùng 108 khi so sánh với hoạt tính colistin tại nồng độ 106 khúm vi trùng và sẽ cần tăng nồng độ thuốc lên gấp 32 lần để giết được vi trùng tại nồng độ 109 so với chỉ 106. Mặc dù cần thêm nghiên cứu trên người và trên thú vật để đánh giá hiệu quả, nghiên cứu này nhấn mạnh rằng liều colistin cao hơn là cần thiết nếu vị trí nhiễm trùng sâu, kín đáo cùng với mật độ vi trùng cao.
Khi đã xác định được liều tối ưu của colistin, số lần dùng thuốc trong ngày cũng là một khía cạnh quan trọng khác cần quan tâm. Một nhóm các nhà nghiên cứu đánh giá hoạt tính kháng vi trùng và sự xuất hiện kháng thuốc trong 3 khoảng liều khác nhau: 8, 12 và 24 giờ.[72] Ba liều lượng khác nhau cho từng khoảng liều sử dụng: 0.23 mg mỗi 8 giờ (0.30 mg liều tải), 0.39 mg mỗi 12 giờ (0.45 mg liều tải) và 0.89 mg mỗi 24 giờ (0.09 mg liều tải). Khoảng liều dùng mỗi 8 giờ cho thấy đạt được nồng độ đỉnh ([Cmax] 3 mg/L) và nồng độ tối thiểu (0.75 mg/L) tại mức ổn định khi colistin được sử dụng theo hướng dẫn của nhà sản xuất. Khoảng liều mỗi 12 giờ hay 24 giờ cho thấy đạt được nồng độ Cmax đích cao hơn (tương ứng 4.5 và 9.0 mg/L). Các nhà nghiên cứu cũng tìm thấy hoạt tính giết và ức chế phát triển vi trùng tương tự ở cả 3 nhóm. Tuy nhiên, sự xuất hiện kháng thuốc tăng với khoảng liều rộng hơn và nhóm liều mỗi 8 giờ cho thấy hiệu quả và ít kháng thuốc nhất. Nồng độ duy trì > MIC trong khoảng 72 giờ điều trị đạt 80%, 72% và 53% tương ứng với liều sử dụng mỗi 8, 12 và 24 giờ. Vì đề kháng colistin tiếp tục gia tăng, cho nên điều này thật sự rất quan trọng. Thêm vào đó, mỗi loại nhiễm trùng khác nhau có thể làm thay đổi dược lực của thuốc cho nên điều này cần được tính toán thêm khi xác định liều của colistin và colistimethate natri.
Liều lượng thuốc trên những bệnh nhân nặng
Ở những bệnh nhân nặng với rối loạn chức năng đa cơ quan và nhiễm trùng nặng do tác nhân đa kháng thì việc chọn lựa điều trị đặc biệt rất hạn chế. Colistin vẫn cho thấy là một lựa chọn cuối cùng quan trọng trên những bệnh nhân này. Tuy nhiên, điều gì chúng ta thực sự cần quan tâm: Đó là việc thiếu các hướng dẫn lâm sàng và khuyến cáo liều hiện tại chưa rõ ràng ở nhóm bệnh nhân này?
Bằng chứng gần đây cho thấy dược động của colistimethate natri và colistin ở nhóm bệnh nhân nặng khác biệt hẳn với nhóm bệnh nhân xơ nang phổi đã được nghiên cứu trước đó.[68] Sự khác biệt này rất quan trọng trong khi xem xét, bởi vì ở bệnh nhân bệnh nặng thường đi kèm suy đa cơ quan, nhiễm trùng huyết hay nhiều mức độ suy giảm chức năng thận. Mặc dù thời gian bán hủy của colistin ở bệnh nhân xơ nang chỉ khoảng 4 giờ, nó sẽ kéo dài hơn ở bệnh nhân bệnh nặng.[68] Thời gian bán hủy sẽ lên đến 14.4 giờ ở bệnh nhân bệnh nặng và tốc độ chuyển đổi từ colistimethate natri thành colistin cũng khác so với các dữ liệu đã được báo cáo trước đây.[74] Cùng với đó là thể tích phân bố lớn hơn và nồng độ kháng sinh thấp hơn sẽ được tìm thấy ở bệnh nhân bệnh nặng với nhiễm trùng huyết.[75] Khác biệt này có khả năng tác động đến hiệu quả của colistimethate natri và colistin, cho nên cần xem xét điều chỉnh liều lượng khi sử dụng trong trường hợp này. Mặc dù những dữ liệu về dược động và dược lực ở nhóm bệnh nhân này rất khan hiếm, một vài nghiên cứu đã cho chúng tôi cái nhìn sâu hơn liên quan những điều chỉnh cần thiết khi xác định liều ở nhóm bệnh nhân này.
Một nhóm tác giả thực hiện một phân tích đánh giá dược động của colistin sau khi truyền tĩnh mạch colistimethate natri ở những bệnh nhân bệnh nặng.[74] Những bệnh nhân này nhận 3 triệu UI colistimethate natri tĩnh mạch mỗi 8 giờ (240mg) hoặc 160mg mỗi 8 giờ nếu độ thanh thải creatinine dưới 50 ml/phút. Cmax dự đoán là 0.60 mg/L sau liều đầu tiên và 2.3 mg/L trong giai đoạn ổn định. Những tác giả tìm thấy nồng độ colistin sau một vài liều đầu tiên thấp hơn ngưỡng MIC khuyến cáo của CLSI là 2mg/L đối với tác nhân P. aeruginosa và Enterobacteriaceae. Hơn nữa, nồng độ huyết tương này cũng dưới ngưỡng MIC trong giai đoạn ổn định trong nhiều trường hợp. Những kết quả này cần được quan tâm đặc biệt ở bệnh nhân bệnh nặng vì trì hoãn trong việc điều trị thích hợp hay việc dùng thuốc hiện tại không đạt tối ưu có thể đưa đến tình trạng kháng thuốc và hậu quả cuối cùng sẽ làm gia tăng tử vong. Những tác giả khuyến cáo việc dùng liều tải colistimethate natri là cần thiết. Với 3 triệu UI mỗi 8 giờ sẽ mất 2-3 ngày để đạt được nồng độ ổn định. Vì vậy những tác giả đề nghị sử dụng liều tải 9 hay 12 triệu UI colistimethate natri cùng với liều duy trì 4.5 triệu UI mỗi 12 giờ với tốc độ dùng nhanh hơn và ít cần sự duy trì thường xuyên.
Tương tự, một nhóm tác giả khác cũng đi tìm nồng độ huyết thanh của thuốc trong giai đoạn ổn định sau khi dùng 225 mg mỗi 8 giờ colistimethate đường tĩnh mạch ở 14 bệnh nhân.[75] Cmax trung bình là 2.93 mg/L. Tuy nhiên các tác giả chú ý điều này có thể đưa đến tỷ số Cmax:MIC không tối ưu cho những dòng vi khuẩn với MIC cao hơn như A.baumannii và P. aeruginosa. Những nhà nghiên cứu cũng kết luận rằng liều cao hơn colistimethate natri sẽ cần được tính đến. Từ hai nghiên cứu này cho thấy cần có những nghiên cứu xa hơn liên quan việc sử dụng colistimethate natri liều cao hơn ở bệnh nhân bệnh nặng để xác định liệu như thế có cải thiện được hiệu quả cũng như không làm tăng thêm tính độc của thuốc.
Những thông số về dược động của colistimethate natri và colistin được đánh giá thêm ở bệnh nhân bệnh thận giai đoạn 5 hay ở bệnh nhân với bệnh gan nặng với nhóm đối chứng người khỏe mạnh.[76] Độ thanh thải colistimethate natri được tìm thấy thấp hơn ở nhóm bệnh nhân bệnh thận trong khi các chỉ số Cmax, thời gian bán hủy và AUC thì cao hơn. Thêm vào đó, sự chuyển đổi từ colistimethate natri thành colistin và việc phơi nhiễm colistin cũng kéo dài hơn ở nhóm bệnh nhân này trong khi thanh thải colsitin thì giảm. Có khả năng những kết quả này sẽ dẫn đến tác dụng độc thần kinh và thật sự đã có 3-10 trường hợp ở nhóm bệnh nhân bị bệnh thận xuất hiện cảm giác dị cảm (mặc dù điều này biến mất sau 24-48 giờ) trong khi không có bệnh nhân nào trong nhóm bệnh gan xuất hiện triệu chứng trên. Trước đây, liều khuyến cáo là 2.5 mg/kg mỗi 48 giờ ở nhóm bệnh nhân điều trị thay thế thận[77] nhưng liều này dường như cho thấy không đủ trong một vài trường hợp.[78] Nghiên cứu này nhấn mạnh việc cần thiết phải điều chỉnh liều ở bệnh nhân suy thận.
Đối với bệnh nhân bệnh nặng, thời gian bán hủy colistin kéo dài hơn do đó nên xem xét kéo dài khoảng giữa các liều. Tuy nhiên, một vài nghiên cứu cho thấy rằng khi kéo dài thời gian giữa các liều colistin, tỷ lệ kháng thuốc lại gia tăng.[72] Kết cục này cần được cân nhắc khi quyết định kéo dài thời gian giữa các liều sử dụng.
Tóm lại, những dữ liệu này cho thấy dược động colistin thay đổi rất nhiều ở những bệnh nhân bệnh nặng. Liều sử dụng colistimethate natri cao hơn và điều chỉnh khoảng cách giữa các liều có thể cần thiết để đạt được tỷ số AUC:MIC tối ưu (một thông số tiên đoán dược lực của colistin).Tuy nhiên, do độc tính của colistin nên điều này có thể không đạt được. Trong những trường như vậy, điều trị phối hợp thêm kháng sinh nên được xem xét để đạt được điều trị tối ưu và ngăn ngừa tình trạng kháng thuốc.
Kết Luận
Colistin đã cho thấy là một chọn lựa thay thế quan trọng trong điều trị nhiễm trùng các tác nhân gram âm đa kháng. Tuy nhiên, những báo cáo liên quan những dòng vi khuẩn kháng colistin vẽ ra một bối cảnh nguy hiểm tiềm tàng vì colistin đóng vai trò như một thuốc bảo vệ cuối cùng. Đề kháng colistin được cho là liên quan hệ thống điều hòa PmrA-PmrB và PhoP-PhoQ cùng với những đáp ứng của nó với thay đổi môi trường. Kích hoạt hệ thống điều hòa PmrA-PmrB và PhoP-PhoQ tạo ra sự đề kháng thuốc bằng cách kích hoạt những gen liên quan, giảm tích điện âm màng tế bào và giảm số vị trí gắn kết của các ion dương polymyxin. Mặc dù những nghiên cứu này đã tìm thấy một số cơ chế đề kháng colistin, những nghiên cứu sâu hơn thật sự cần thiết để hiểu đầy đủ hơn về tác động của hệ thống điều hòa này lên việc kháng thuốc cũng như xác định liều colistin cần thiết để ức chế và đè bẹp những tác nhân kháng thuốc đang dần nổi lên này.
Đề kháng colistin xuất hiện liên quan với liều sử dụng không đầy đủ. Điều này nhấn mạnh việc sử dụng liều tối ưu đặc biệt ở những bệnh nhân nặng nhiễm tác nhân đa kháng. Mặc dù liều cao hơn có thể có lợi ích nhưng việc thiếu dữ liệu về dược động và dược lực của colistin khiến việc chọn liều thích hợp rất khó khăn. Tuy nhiên, colistin vẫn là một chọn lựa nền tảng cho nhiễm trùng gram âm đa kháng (những trường hợp mắc bệnh với những dòng kháng thuốc nên là mối quan tâm nhiều hơn). Do đó, nghiên cứu những thuốc mới hơn và việc điều trị phối hợp kháng sinh với colistin vẫn là một lộ trình để tối ứu hóa trong cuộc chiến chống lại nhiễm trùng gram âm kháng thuốc cao và ngày càng mạnh mẽ.
Lauren M. Lim, Pharm.D.; Neang Ly, B.S.; Dana Anderson, Pharm.D.; Jenny C. Yang, Pharm.D.; Laurie Macander, Pharm.D.; Anthony Jarkowski, III, Pharm.D.; Alan Forrest, Pharm.D.; Jurgen B. Bulitta, Ph.D.; Brian T. Tsuji, Pharm.D.
Posted: 12/09/2010; Pharmacotherapy. 2010;30(12):1279-1291. © 2010 Pharmacotherapy Publications
Người dịch: Nguyễn Hồ Lam
Tài liệu tham khảo
-
Talbot GH, Bradley J, Edwards JE Jr, Gilbert D, Scheld M, Bartlett JG. Bad bugs need drugs: an update on the development pipeline from the antimicrobial availability task force of the Infectious Diseases Society of America. Clin Infect Dis 2006;42:657–68. (Erratum in Clin Infect Dis 2006;42: 1065.
-
Li J, Nation RL, Milne RW, Turnidge JD, Coulthard K. Evaluation of colistin as an agent against multi-resistant gram-negative bacteria. Int J Antimicrob Agents 2005;25:11–25.
-
Falagas ME, Kasiakou SK, Tsiodras S, Michalopoulos A. The use of intravenous and aerosolized polymyxins for the treatment of infections in critically ill patients: a review of the recent literature. Clin Med Res 2006;4:138–46.
-
Falagas ME, Kasiakou SK. Colistin: the revival of polymyxins for the management of multidrug-resistant gram-negative bacterial infections. Clin Infect Dis 2005;40:1333–41.
-
Li J, Nation RL, Turnidge JD, et al. Colistin: the re-emerging antibiotic for multidrug-resistant gram-negative bacterial infections. Lancet Infect Dis 2006;6:589–601.
-
Li J, Coulthard K, Milne R, et al. Steady-state pharmacokinetics of intravenous colistin methanesulphonate in patients with cystic fibrosis. J Antimicrob Chemother 2003;52:987–92.
-
Li J, Milne RW, Nation RL, Turnidge JD, Coulthard K. Stability of colistin and colistin methanesulfonate in aqueous media and plasma as determined by high-performance liquid chromatography. Antimicrob Agents Chemother 2003;47: 1364–70.
-
Bergen PJ, Li J, Rayner CR, Nation RL. Colistin methanesulfonate is an inactive prodrug of colistin against Pseudomonasaeruginosa. Antimicrob Agents Chemother 2006;50:1953–8.
-
Rodriguez CH, Pautaso J, Bombicino K, Vay C, Famiglietti A. Sensitivity to colistin: evaluation of cut-off points available in disk diffusion test [in Spanish]. Rev Argent Microbiol 2004;36:125–9.
-
Li J, Milne RW, Nation RL, Turnidge JD, Smeaton TC, Coulthard K. Use of high-performance liquid chromatography to study the pharmacokinetics of colistin sulfate in rats following intravenous administration. Antimicrob Agents Chemother 2003;47:1766–70.
-
Storm DR, Rosenthal KS, Swanson PE. Polymyxin and related peptide antibiotics. Annu Rev Biochem 1977;46:723–63.
-
Dixon RA, Chopra I. Leakage of periplasmic proteins from Escherichia coli mediated by polymyxin B nonapeptide. Antimicrob Agents Chemother 1986;29:781–8.
-
Peterson AA, Hancock RE, McGroarty EJ. Binding of polycationic antibiotics and polyamines to lipopolysaccharides of Pseudomonas aeruginosa. J Bacteriol 1985;164:1256–61.
-
Kasiakou SK, Rafailidis PI, Liaropoulos K, Falagas ME. Cure of post-traumatic recurrent multiresistant gram-negative rod meningitis with intraventricular colistin. J Infect 2005;50: 348–52.
-
Li J, Rayner CR, Nation RL, et al. Heteroresistance to colistin in multidrug-resistant Acinetobacter baumannii. Antimicrob Agents Chemother 2006;50:2946–50.
-
Galani I, Kontopidou F, Souli M, et al. Colistin susceptibility testing by Etest and disk diffusion methods. Int J Antimicrob Agents 2008;31:434–9.
-
Arroyo LA, Garcia-Curiel A, Pachon-Ibanez ME, et al. Reliability of the E-test method for detection of colistin resistance in clinical isolates of Acinetobacter baumannii. J Clin Microbiol 2005;43:903–5.
-
Ko KS, Suh JY, Kwon KT, et al. High rates of resistance to colistin and polymyxin B in subgroups of Acinetobacterbaumannii isolates from Korea. J Antimicrob Chemother 2007;60:1163–7.
-
Yau W, Owen RJ, Poudyal A, et al. Colistin heteroresistance in multidrug-resistant Acinetobacter baumannii clinical isolates from the western pacific region in the SENTRY antimicrobial surveillance programme. J Infect 2009;58:138–44.
-
Doi Y, Husain S, Potoski B, et al. Extensively drug-resistant Acinetobacter baumannii. Emerg Infect Dis 2009;15:980–2.
-
Li J, Nation RL, Owen RJ, Wong S, Spelman D, Franklin C. Antibiograms of multidrug-resistant clinical Acinetobacterbaumannii: promising therapeutic options for treatment of infection with colistin-resistant strains. Clin Infect Dis 2007;45:594–8.
-
Hawley JS, Murray CK, Griffith ME, et al. Susceptibility of Acinetobacter strains isolated from deployed U.S. military personnel. Antimicrob Agents Chemother 2007;51:376–8.
-
Hernan RC, Karina B, Gabriela G, Marcela N, Carlos V, Angela F. Selection of colistin-resistant Acinetobacter baumannii isolates in postneurosurgical meningitis in an intensive care unit with high presence of heteroresistance to colistin. Diagn Microbiol Infect Dis 2009;65:188–91.
-
Li J, Turnidge J, Milne R, Nation RL, Coulthard K. In vitro pharmacodynamic properties of colistin and colistin methanesulfonate against Pseudomonas aeruginosa isolates from patients with cystic fibrosis. Antimicrob Agents Chemother 2001;45:781–5.
-
Schulin T. In vitro activity of the aerosolized agents colistin and tobramycin and five intravenous agents against Pseudomonasaeruginosa isolated from cystic fibrosis patients in southwestern Germany. J Antimicrob Chemother 2002;49:403–6.
-
Denton M, Kerr K, Mooney L, et al. Transmission of colistin-resistant Pseudomonas aeruginosa between patients attending a pediatric cystic fibrosis center. Pediatr Pulmonol 2002;34: 257–61.
-
Antoniadou A, Kontopidou F, Poulakou G, et al. Colistin-resistant isolates of Klebsiella pneumoniae emerging in intensive care unit patients: first report of a multiclonal cluster. J Antimicrob Chemother 2007;59:786–90.
-
Poudyal A, Howden B, Bell J, et al. In vitro pharmacodynamics of colistin against multidrug-resistant Klebsiella pneumoniae. J Antimicrob Chemother 2008;62:1311–18.
-
Suh J-Y, Son J, Chung D, et al. Nonclonal emergence of colistin-resistant Klebsiella pneumoniae isolates from blood samples in South Korea. Antimicrob Agents Chemother 2010;54:560–2.
-
Owen RJ, Li J, Nation RL, Spelman D. In vitro pharmaco-dynamics of colistin against Acinetobacter baumannii clinical isolates. J Antimicrob Chemother 2007;59:473–7.
-
Tan TY, Ng LS, Tan E, Huang G. In vitro effect of minocycline and colistin combinations on imipenem-resistant Acinetobacterbaumannii clinical isolates. J Antimicrob Chemother 2007;60:421–3.
-
Tan CH, Li J, Nation RL. Activity of colistin against heteroresistant Acinetobacter baumannii and emergence of resistance in an in vitro pharmacokinetic/pharmacodynamic model. Antimicrob Agents Chemother 2007;51:3413–15.
-
Macfarlane EL, Kwasnicka A, Ochs MM, Hancock RE. PhoP-PhoQ homologues in Pseudomonas aeruginosa regulate expression of the outer-membrane protein OprH and polymyxin B resistance. Mol Microbiol 1999;34:305–16.
-
Gunn JS, Ryan SS, Van Velkinburgh JC, Ernst RK, Miller SI. Genetic and functional analysis of a PmrA-PmrB-regulated locus necessary for lipopolysaccharide modification, antimicrobial peptide resistance, and oral virulence of Salmonella enterica Serovar Typhimurium. Infect Immun 2000;68:6139–46.
-
Soncini FC, Groisman EA. Two-component regulatory systems can interact to process multiple environmental signals. J Bacteriol 1996;27:6796–801.
-
McPhee JB, Bains M, Winsor G, et al. Contribution of the PhoP-PhoQ and PmrA-PmrB two-component regulatory systems to Mg2+-induced gene regulation in Pseudomonasaeruginosa. J Bacteriol 2006;188:3995–4006.
-
McPhee JB, Lewenza S, Hancock RE. Cationic antimicrobial peptides activate a two-component regulatory system, PmrAPmrB, that regulates resistance to polymyxin B and cationic antimicrobial peptides in Pseudomonas aeruginosa. Mol Microbiol 2003;50:205–17.
-
Moskowitz SM, Ernst RK, Miller SI. PmrAB, a two-component regulatory system of Pseudomonas aeruginosa that modulates resistance to cationic antimicrobial peptides and addition of aminoarabinose to lipid A. J Bacteriol 2004;186:575–9.
-
Trent MS, Ribeiro AA, Lin S, Cotter RJ, Raetz CR. An inner membrane enzyme in Salmonella and Escherichia coli that transfers 4-amino-4-deoxy-L-arabinose to lipid A: induction on polymyxin-resistant mutants and role of a novel lipid-linked donor. J Biol Chem 2001;276:43122–31.
-
Zhang L, Dhillon P, Yan H, Farmer S, Hancock RE. Interactions of bacterial cationic peptide antibiotics with outer and cytoplasmic membranes of Pseudomonas aeruginosa. Antimicrob Agents Chemother 2000;44:3317–21.
-
Perez JC, Groisman EA. Acid pH activation of the PmrA/PmrB two-component regulatory system of Salmonella enterica. Mol Microbiol 2007;63:283–93.
-
Gunn JS, Miller SI. PhoP-PhoQ activates transcription of pmrAB, encoding a two-component regulatory system involved in Salmonella typhimurium antimicrobial peptide resistance. J Bacteriol 1996;178:6857–64.
-
Gunn JS, Lim KB, Krueger J, et al. PmrA-PmrB-regulated genes necessary for 4-aminoarabinose lipid A modification and polymyxin resistance. Mol Microbiol 1998;27:1171–82.
-
Groisman EA, Kayser J, Soncini FC. Regulation of polymyxin resistance and adaptation to low-Mg2+ environments. J Bacteriol 1997;179:7040–5.
-
Macfarlane EL, Kwasnicka A, Hancock RE. Role of Pseudomonas aeruginosa PhoP-phoQ in resistance to antimicrobial cationic peptides and aminoglycosides. Microbiology 2000;146(pt 10):2543–54.
-
Nicas TI, Hancock RE. Alteration of susceptibility to EDTA, polymyxin B and gentamicin in Pseudomonas aeruginosa by divalent cation regulation of outer membrane protein H1. J Gen Microbiol 1983;129:509–17.
-
Nicas TI, Hancock RE. Outer membrane protein H1 of Pseudomonas aeruginosa: involvement in adaptive and mutational resistance to ethylenediaminetetraacetate, polymyxin B, and gentamicin. J Bacteriol 1980;143:872–8.
-
Kwon DH, Lu CD. Polyamines induce resistance to cationic peptide, aminoglycoside, and quinolone antibiotics in Pseudomonas aeruginosa PAO1. Antimicrob Agents Chemother 2006;50:1615–22.
-
Soon RL, Nation RL, Hartley PG, Larson I, Li J. Atomic force microscopy investigation of the morphology and topography of colistin-heteroresistant Acinetobacter baumannii strains as a function of growth phase and in response to colistin treatment. Antimicrob Agents Chemother 2009;53:4979–86.
-
Falagas ME, Kasiakou SK. Toxicity of polymyxins: a systematic review of the evidence from old and recent studies [online exclusive article]. Crit Care 2006;10:R27. Available from http://ccforum.com/content/10/1/R27.
-
Kasiakou SK, Michalopoulos A, Soteriades ES, Samonis G, Sermaides GJ, Falagas ME. Combination therapy with intravenous colistin for management of infections due to multidrug-resistant gram-negative bacteria in patients without cystic fibrosis. Antimicrob Agents Chemother 2005;49: 3136–46.
-
Falagas ME, Bliziotis IA, Kasiakou SK, Samonis G, Athanassopoulou P, Michalopoulos A. Outcome of infections due to pandrug-resistant (PDR) gram-negative bacteria [online exclusive article]. BMC Infect Dis 2005;5:24. Available from http://www.biomedcentral.com/1471-2334/5/24.
-
Reina R, Estenssoro E, Saenz G, et al. Safety and efficacy of colistin in Acinetobacter and Pseudomonas infections: a prospective cohort study. Intensive Care Med 2005;31:1058–65.
-
Cheng C-Y, Sheng W-H, Wang J-T, et al. Safety and efficacy of intravenous colistin (colistin methanesulphonate) for severe multidrug-resistant gram-negative bacterial infections. Int J Antimicrob Agents 2010;25:297–300.
-
Al-Aloul M, Miller H, Alapati S, Stockton PA, Ledson MJ, Walshaw MJ. Renal impairment in cystic fibrosis patients due to repeated intravenous aminoglycoside use. Pediatr Pulmonol 2005;39:15–20.
-
Santamaria C, Mykietiuk A, Temporiti E. Nephrotoxicity associated with the use of intravenous colistin. Scand J Infect Dis 2009;41:767–9.
-
Li J, Rayner CR, Nation RL. Colistin-associated acute renal failure: revisited. South Med J 2005;98:1229–30.
-
Conway SP, Etherington C, Munday J, Goldman MH, Strong JJ, Wootton M. Safety and tolerability of bolus intravenous colistin in acute respiratory exacerbations in adults with cystic fibrosis. Ann Pharmacother 2000;34:1238–42.
-
Falagas ME, Rizos M, Bliziotis IA, Rellos K, Kasiakou SK, Michalopoulos A. Toxicity after prolonged (more than four weeks) administration of intravenous colistin [online exclusive article]. BMC Infect Dis 2005;5:1. Available from http://www.biomedcentral.com/1471-2334/5/1.
-
Hartzell J, Neff R, Ake J. Nephrotoxicity associated with intravenous colistin (colistimethate sodium) treatment at a tertiary care medical center. Clin Infect Dis 2009;48:1724–8.
-
Falgas M, Fragoulis K, Kasiakou S, et al. Nephrotoxicity of intravenous colistin: a prospective evaluation. Int J Antimicrob Agents 2005;26:504–7.
-
Kim J, Lee K-H, Yoo S, et al. Clinical characteristics and risk factors of colistin-induced nephrotoxicity. Int J Antimicrob Agents 2009;34:434–8.
-
Ledson MJ, Gallagher MJ, Cowperthwaite C, Convery RP, Walshaw MJ. Four years' experience of intravenous Colomycin in an adult cystic fibrosis unit. Eur Respir J 1998;12:592–4.
-
Conway SP, Pond MN, Watson A, Etherington C, Robey HL, Goldman MH. Intravenous colistin sulphomethate in acute respiratory exacerbations in adult patients with cystic fibrosis. Thorax 1997;52:987–93.
-
Assadamongkol K, Tapaneya-Olarn W, Chatasingh S. Urinary N-acetyl-beta-D-glucosaminidase (NAG) in aminoglycoside nephrotoxicity. J Med Assoc Thai 1989;72(suppl 1):42–6.
-
Molina J, Cordero E, Pachon J. New Information about the polymyxin/colistin class of antibiotics. Expert Opin Pharmacother 2009;10:2811–28.
-
Garnacho-Montero J, Ortiz-Leyba C, Jimenez-Jimenez FJ, et al. Treatment of multidrug-resistant Acinetobacter baumannii ventilator-associated pneumonia (VAP) with intravenous colistin: a comparison with imipenem-susceptible VAP. Clin Infect Dis 2003;36:1111–18.
-
Nation R, Li J. Colistin in the 21st century. Curr Opin Infect Dis 2009 2009;22:535–43.
-
Forest Laboratories Ltd. Colomycin (colistimethate sodium) injection summary of product characteristics. Bexley, Kent, United Kingdom; 2010.
-
Monarch Pharmaceuticals. Coly-Mycin M (colistimethate) parenteral package insert. Bristol, TN; 2005.
-
Dudhani RV, Turnidge JD, Coulthard K, et al. Elucidation of the pharmacokinetic/pharmacodynamic determinant of colistin activity against Pseudomonas aeruginosa in murine thigh and lung infection models. Antimicrob Agents Chemother 2010;54:1117–24.
-
Bergen PJ, Li J, Nation RL, Turnidge JD, Coulthard K, Milne RW. Comparison of once-, twice- and thrice-daily dosing of colistin on antibacterial effect and emergence of resistance: studies with Pseudomonas aeruginosa in an in vitro pharmaco-dynamic model. J Antimicrob Chemother 2008;61:636–42.
-
Bulitta JB, Yang JC, Yohonn L, et al. Attenuation of colistin bactericidal activity by high inoculum of Pseudomonasaeruginosa characterized by a new mechanism-based population pharmacodynamic model. Antimicrob Agents Chemother 2010;54:2051–62.
-
Plachouras D, Karvanen M, Friberg L, et al. Population pharmacokinetic analysis of colistin methanesulfonate and colistin after intravenous administration in critically ill patients with infections caused by gram-negative bacteria. Antimicrob Agents Chemother 2009;53:3430–6.
-
Markou N, Markantonis S, Dimitrakis E, et al. Colistin serum concentrations after intravenous administration in critically ill patients with serious multidrug-resistant, gram-negative bacilli infections: a prospective, open-label, uncontrolled study. Clin Ther 2008;30:143–51.
-
Haas C, Kaufman D, Forrest A, et al. Colistin pharmaco-kinetics in the presence of renal and liver disease. Presented at the Society of Critical Care Medicine 39th critical care congress, Miami, FL, January 9–13, 2010.
-
Trotman R, Williamson J, Shoemaker M, et al. Antibiotic dosing in critically ill adult patients receiving continuous renal replacement therapy. Clin Infect Dis 2005;41:1159–66.
-
Li J, Milne RW, Nation RL, Turnidge JD, Smeaton TC, Coulthard K. Pharmacokinetics of colistin methanesulphonate and colistin in rats following an intravenous dose of colistin methanesulphonate. J Antimicrob Chemother 2004;53:837–40.