Chuyên đề
- Chi tiết
-
Được đăng: 29 Tháng 12 2018
Ngô Nguyễn Hải Thanh
Trần Văn Ngọc
TÓM TẮT
Mở đầu: Corticoid dạng hít (ICS) là điều trị nền tảng trong hen. Tuy nhiên, vẫn còn 10 – 15% bệnh nhân hen kiểm soát kém dù đã được điều trị tối ưu. Mối liên quan giữa đa hình rs37972 trên gen GLCCI1 và đáp ứng với corticoid hít ở bệnh nhân hen da trắng đã được báo cáo.
Mục tiêu: Xác định mối liên quan giữa đa hình rs37972 trên gen GLCCI1 và đáp ứng với corticoid hít ở bệnh nhân hen Việt Nam.
Phương pháp: Nghiên cứu cắt ngang mô tả, đánh giá mức độ kiểm soát triệu chứng hen và kết quả chức năng hô hấp của 92 bệnh nhân hen từ 18 tuổi trở lên tại các thời điểm: lúc bắt đầu điều trị ICS, sau điều trị 3 tháng, 6 tháng và 12 tháng. Xác định kiểu gen rs37972 bằng phương pháp giải trình tự trực tiếp, DNA li trích từ máu toàn phần.
Kết quả: Tỉ lệ alen nguy cơ (alen T) là 48%. Tỉ lệ kiểm soát triệu chứng hen sau 12 tháng điều trị ICS liên tục ở các bệnh nhân mang kiểu gen CC cao hơn kiểu gen TT, sự khác biệt này chỉ rõ ràng ở nhóm bệnh nhân không có tiếp xúc nghề nghiệp liên quan hen (92,3% so với 41,7%, p=0,011). Tương tự, các bệnh nhân mang kiểu gen CC có mức FEV1 cải thiện cao hơn so với nhóm mang các kiểu gen CT và TT sau điều trị ICS 3 tháng (118% so với 32%, p=0,05) cũng như 6 tháng (69,5% so với 30,9%, p=0,006).
Kết luận: Nghiên cứu bước đầu gợi ý có mối liên quan giữa đa hình rs37972 trên gen GLCCI1 và đáp ứng với corticoid hít ở bệnh nhân hen Việt Nam.
Từ khóa: GLCCI1, đáp ứng với corticoid hít, hen.
ABSTRACT
ASSOCIATION BETWEEN THE GLCCI1 VARIANT AND RESPONSE TO INHALED CORTICOSTEROIDS IN VIETNAMESE ASTHMATICS
Background: Inhaled corticosteroids (ICS) is the mainstay of asthma treatment. Unfortunately, about 10 – 15% of patients still have poor asthma control despite receiving optimal therapy. A significant association between the GLCCI1 variant rs37972 and response to ICS in Caucasian asthmatics has been reported.
Objective: to determine whether variant rs37972 related to ICS efficacy in Vietnamese asthmatics.
Method: We enrolled 92 adult patients and assessed their asthma control as well as spirometry testing over the first 12 months starting ICS therapy at 4 time points: at starting ICS treatment, after 3 months, 6 months and 12 months. Genotyping for rs37972 was done with direct sequencing method using DNA extracted from whole blood samples.
Result: The frequency of the risk allele (“T” allele) was 48%. The rate of asthma control in patients who had CC genotype was higher than TT genotyped patients after 12 months continuously treated with ICS. This genotype-dependent difference was only evident among patients unexposed to occupational asthmagens (92.3% vs 41.7%, p=0.011). Similarly, the CC genotype had the improvement of FEV1 better than the CT and TT genotype after ICS therapy not only 3 months (118% vs 32%, p=0.05) but also 6 months (69.5% vs 30.9%, p=0.006).
Conclusion: This primary study in the assessment of GLCCI1 variant suggested an association between SNP rs37972 and ICS response in Vietnamese asthmatics.
Keywords: GLCCI1, inhaled corticosteroid response, asthma.
ĐẶT VẤN ĐỀ:
Hen là một trong các bệnh lí hô hấp thường gặp. Corticoid dạng hít (ICS) là thuốc điều trị nền tảng trong hen, hầu hết bệnh nhân chỉ cần liều thấp ICS để kiểm soát hen hiệu quả [8], tuy nhiên, vẫn còn 10 – 20% bệnh nhân phải sử dụng liều cao và thậm chí 1% phải duy trì corticoid dạng uống kéo dài [15], [17]. Ngày nay, người ta đã tìm ra nhiều cơ chế sinh học phân tử giải thích hiện tượng giảm đáp ứng với ICS, một trong số đó có liên quan đến sự giảm biểu hiện của các gen được điều hòa bởi corticoid [7], [10]. Gen GLCCI1 (Glucocorticoid-induced transcript 1) biểu hiện nhiều ở phổi và các tổ chức lympho [2], có vai trò trong việc điều hòa đáp ứng của corticoid. Một số nghiên cứu trên thế giới cho thấy có sự liên quan giữa SNP rs37972 và đáp ứng với ICS trên bệnh nhân hen. SNP rs37972 liên quan đến mức độ kiểm soát triệu chứng, mức độ cải thiện trị số FEV1 sau sử dụng ICS ngắn hạn (2-6 tháng) [2], [6], [14], cũng như quá trình suy giảm chức năng hô hấp mỗi năm [1].
MỤC TIÊU NGHIÊN CỨU:
Xác định đa hình rs37972 trên gen GLCCI1.
Bước đầu phân tích mối liên hệ giữa kiểu gen rs37972 với mức độ kiểm soát triệu chứng và mức độ thay đổi FEV1 trên bệnh nhân hen có điều trị ICS.
PHƯƠNG PHÁP NGHIÊN CỨU:
Thiết kế nghiên cứu: Cắt ngang mô tả.
Nơi thực hiện: Phòng quản lí hen và khoa nội hô hấp bệnh viện Nhân Dân Gia Định.
Thời gian nghiên cứu: 01/7/2016 – 30/4/2017
Đối tượng nghiên cứu: Bệnh nhân hen từ 18 tuổi trở lên.
Cỡ mẫu: Công thức N= Z21- α/2 p (1 - p)/d2 , chọn mẫu tối thiểu là 92 bệnh nhân.
Z1- α/2 =1,96 (theo bảng), với α= 0,05 (độ tin cậy 95%).
p = 0,4 (tỉ lệ alen T theo nghiên cứu của Tantisira và cộng sự [2]).
d: Sai số cho phép của p, được lấy là 0,1 (10%).
Tiêu chuẩn nhận vào:
- Bệnh nhân ≥ 18 tuổi đã được chẩn đoán hen theo GINA 2017 [5].
- Có ít nhất 2 kết quả chức năng hô hấp: lúc bắt đầu điều trị ICS và sau điều trị 3 tháng hoặc 6 tháng hoặc 12 tháng (kết quả chức năng hô hấp lúc bắt đầu điều trị ICS là bắt buộc).
- Hút thuốc lá dưới 10 gói.năm.
Tiêu chuẩn lọai trừ:
- Bệnh tim, phổi khác kèm theo: lao phổi hoặc tiền căn lao phổi, bệnh phổi tắc nghẽn mạn tính (COPD), dãn phế quản, suy tim.
Phương pháp tiến hành:
Đánh giá đáp ứng với ICS gồm mức độ kiểm soát hen và %FEV1 cải thiện sau điều trị. Mức độ kiểm soát triệu chứng hen và chức năng hô hấp được thu thập từ hồ sơ bệnh án tại các thời điểm: Lúc bắt đầu điều trị ICS, sau điều trị ICS 3 tháng, 6 tháng và 12 tháng. Đánh giá mức độ kiểm soát triệu chứng hen theo GINA 2017. Trong đó chúng tôi chia bệnh nhân thành 2 nhóm kiểm soát và chưa kiểm soát (bao gồm nhóm bệnh nhân kiểm soát 1 phần và không kiểm soát theo GINA 2017). Đánh giá sự thay đổi FEV1: ∆FEV1 = [FEV1 sau 3-6-12 tháng – FEV1trước điều trị ]/ FEV1trước điều trị
Phương pháp giải trình tự gen:
Xét nghiệm giải trình tự gen GLCCI1 được thực hiện tại Trung tâm Y sinh học phân tử Đại học Y Dược Thành Phố Hồ Chí Minh. Genomic DNA được tách chiết bằng bộ kit Illustra blood genomicPrep Mini Spin Kit (GE Healthcare, Anh) và giải trình tự trực tiếp bằng phương pháp Sanger với BigDye® Terminator v3.1 Cycle Sequencing kit (Applied Biosystems, Mỹ). Cặp mồi được sử dụng: Mồi xuôi GLCCI1-F: 5'-CAGACCAATTTGACATTGTG-3' và mồi ngược GLCCI1-R: 5'-GAAGACTGGATCTCTTTTAG-3'. Kết quả giải trình tự được phân tích bằng phần mềm CLC Main Workbench 5.5, so sánh với trình tự chuẩn của gen GLCCI1 mang mã số NG_032073.1 trong GenBank để xác định biến đổi của gen.
Phương pháp phân tích số liệu:
Xử lí số liệu bằng phần mềm thống kê SPSS 20. Đánh giá mối liên hệ giữa SNP rs37972 và mức độ kiểm soát triệu chứng: dùng kiểm định Fisher’s Exact. So sánh mức độ cải thiện FEV1 giữa các nhóm gen: dùng kiểm định phi tham số Mann-Whitney và Kruskal Willis. Hiệu chỉnh nhiễu bằng phân tích hiệp biến (covariate).
KẾT QUẢ:
|
Bảng 1: Kết quả xác định kiểu gen rs37972 |
|
|||||
|
|
Kiểu gen |
Alen |
||||
|
|
CC |
CT |
TT |
C |
T |
|
|
Tần số |
20 |
55 |
17 |
- |
- |
|
|
% |
21,7 |
59,8 |
18,5 |
52 |
48 |
|
|
Bảng 2: Đặc điểm ba nhóm bệnh nhân theo kiểu gen |
||||
|
|
Kiểu gen |
|
||
|
|
CC (n=20) |
CT (n=55) |
TT (n=17) |
Giá trị p |
|
Tuổi tại thời điểm tham gia nghiên cứu (Năm) |
56 ± 12 |
55 ± 11 |
47 ± 11 |
0,011* |
|
Tuổi chẩn đoán hen (Năm) |
39 ± 22 |
37 ± 18 |
30 ± 15 |
0,158* |
|
Giới Nam (%) Nữ (%) |
6 (30) 14 (70) |
15 (27,3) 40 (72,7) |
6 (35,3) 11 (64,7) |
0,815 |
|
Nghề nghiệp nguy cơ (%) |
7 (35) |
14 (25,5) |
4 (23,5) |
0,722 |
|
Hút thuốc lá (%) |
4 (20) |
11 (20) |
4 (23) |
0,937 |
|
Béo phì (%) |
1 (5) |
3 ( 5,5) |
0 |
1 |
|
Viêm mũi (%) |
6 (30) |
31 (56,4) |
9 (52,9) |
0,075 |
|
GERD (%) |
3 (15) |
8 (14,5) |
1 (5,9) |
0,754 |
|
%FEV1 giá trị dự đoán |
63,95 ± 18 |
68,17 ± 15 |
63,65 ± 14 |
0,495** |
|
Thời gian bệnh (Năm) |
10 ± 17 |
11 ± 14 |
11 ± 12 |
0,761** |
|
Thuốc điều trị Budesonide (%) Fluticasone (%) |
11 (55) 9 (45) |
27 (49,1) 28 (50,9) |
9 (52,9) 8 (47,1) |
0,918 |
|
Liều thuốc (mcg) Budesonide Fluticasone |
458 ± 182 955 ± 166 |
515 ± 154 928 ± 178 |
542 ± 148 875 ± 231 |
0,248* 0,706§ |
(* sử dụng phép kiểm Independent Samples T, ** phép kiểm ANOVA one way, § phép kiểm phi tham số Kruskal Wallis, các biến còn lại sử dụng phép kiểm Fisher’s Exact)
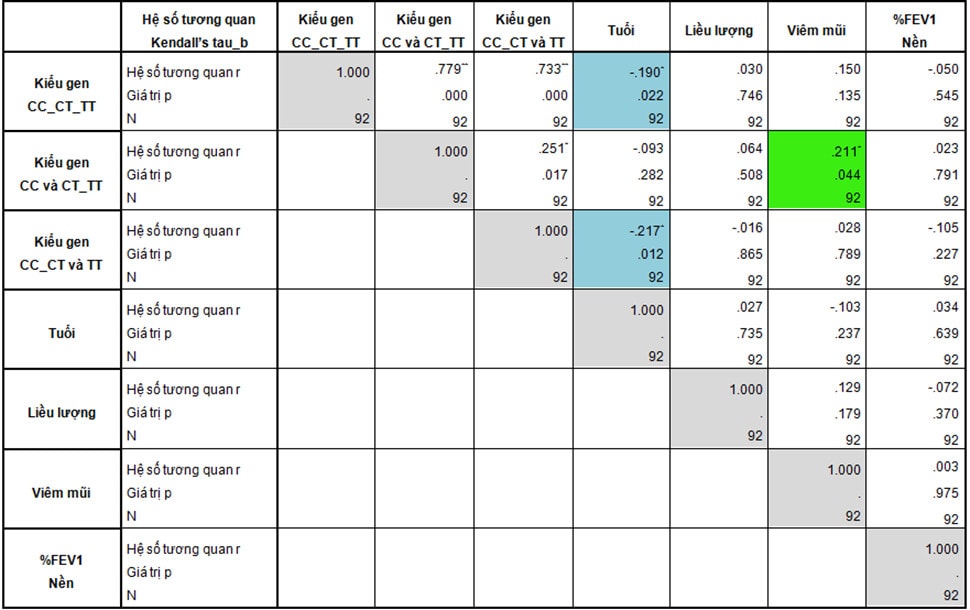
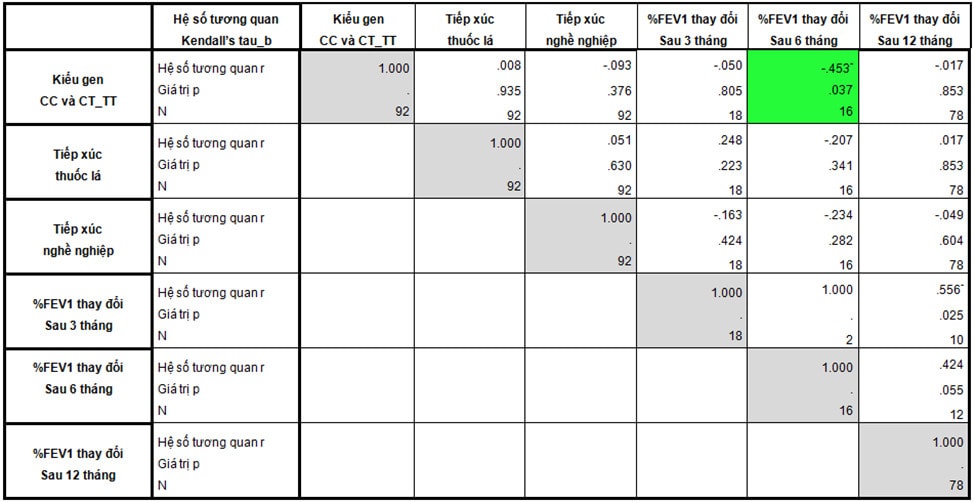
Bảng 3: Tương quan giữa kiểu gen và đặc điểm bệnh nhân hen
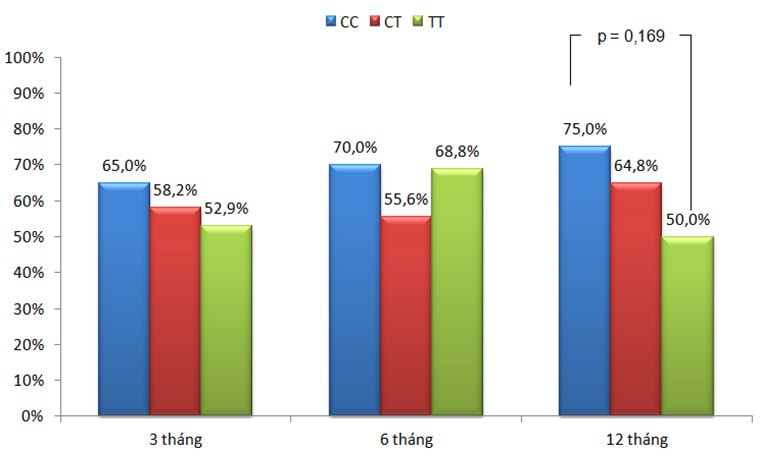
Biểu đồ 1: Tỉ lệ kiểm soát triệu chứng theo kiểu gen.
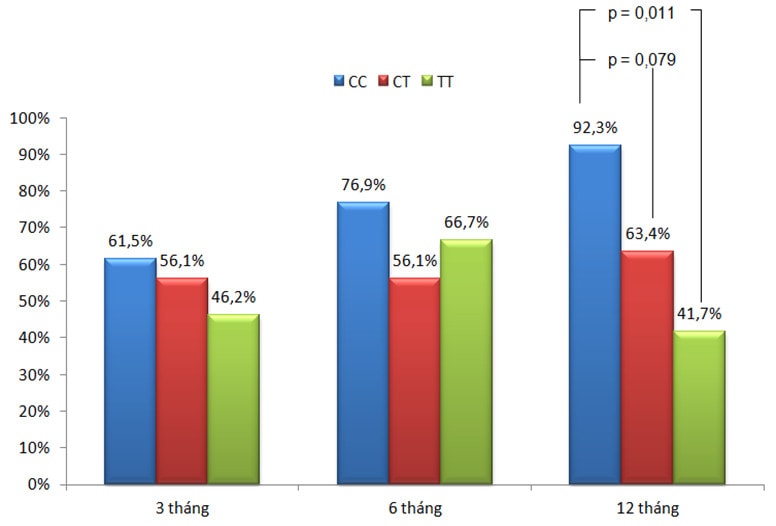
Biểu đồ 2: Tỉ lệ kiểm soát triệu chứng theo kiểu gen trên nhóm bệnh nhân không tiếp xúc nghề nghiệp.
Bảng 4: Tương quan giữa kiểu gen và một số đặc điểm của mẫu nghiên cứu với mức độ cải thiện chức năng hô hấp.
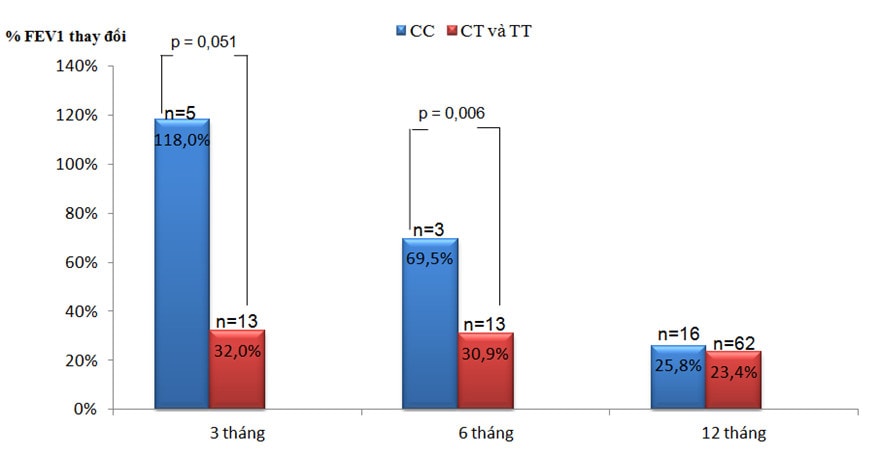
Biểu đồ 3: %FEV1 thay đổi sau điều trị ICS theo kiểu gen.
BÀN LUẬN:
Đa hình rs37972 trên gen GLCCI1:
Chúng tôi giải trình tự trực tiếp toàn bộ 92 mẫu bằng phương pháp tự động Sanger để xác định kiểu gen của rs37972. Đa hình rs37972 trên gen GLCCI1 có các kiểu gen CC, CT và TT chiếm tỉ lệ lần lượt là 21,7%, 59,8% và 18,5%. Mẫu nghiên cứu tuân theo cân bằng Hardy-Weinberg (p > 0,05). Tỉ lệ alen T trong nghiên cứu của chúng tôi là 48%, kết quả này tương đồng với Revathy (Ấn Độ) [18] nhưng cao hơn của Chengping (Trung Quốc) [6], của Al-Muhsen (Ả Rập) [4], và cao hơn tỉ lệ trong các nghiên cứu của Tantisira [2] (Bảng 5). Chúng tôi nhận thấy có sự khác biệt về tần số alen T giữa các dân tộc khác nhau. Do đó, việc khảo sát tính đa hình rs37972 của gen GLCCI1 tại Việt Nam là cần thiết.
|
Bảng 5: Tỉ lệ alen T trên bệnh nhân hen trong các nghiên cứu |
|
|
|
Tỉ lệ alen T (%) |
|
N. N. H. Thanh (n=92) |
48 |
|
Tantisira [2] SOCS-SLIC (n=264) Adult Study (n=385) LOCCS (n=185) |
40 38 38 |
|
Chengping (n=30) [6] |
32 |
|
Al-Muhsen (n=255) [4] |
30 |
|
Revathy (n=78) [18] |
48 |
Như vậy, alen “nguy cơ” T hiện diện với tỉ lệ đáng kể trong nhóm bệnh nhân hen Việt Nam. Hiện tại, ở Việt Nam chưa có số liệu về tần suất alen T trên người khỏe mạnh. Tuy nhiên, so với báo cáo của một số quốc gia trong khu vực cũng như trên thế giới, tỉ lệ alen T trên bệnh nhân hen trong nghiên cứu của chúng tôi cũng cao hơn ở người khỏe mạnh (Bảng 6).
|
Bảng 6: Tỉ lệ alen T trên người khỏe mạnh ở một số quốc gia [18] |
|
|
Dân số |
Tỉ lệ alen T (%) |
|
Ả Rập [4] |
34 |
|
Nhật Bản |
38,4 |
|
Trung Quốc |
39 |
|
Nigeria |
17,8 |
|
Tây Phi |
28,6 |
|
Ý |
37,4 |
|
Mexico |
46 |
Đặc điểm ba nhóm bệnh nhân theo kiểu gen rs37972: (Bảng 2)
Tuổi trung bình của nhóm mang kiểu gen TT (47 ± 11 tuổi) thấp hơn có ý nghĩa thống kê so với nhóm CC (56 ± 12 tuổi) và nhóm CT (55 ± 11 tuổi) (p=0,011). Khi phân tích tương quan, chúng tôi ghi nhận kiểu gen và tuổi bệnh nhân có tương quan với nhau (p=0,012), mặc dù tương quan này chỉ ở mức yếu (r = - 0,217) (Bảng 3). Điều này gợi ý liên quan giữa kiểu gen TT và kiểu hình hen, những bệnh nhân hen mang kiểu gen TT khởi phát bệnh sớm hơn. Ngoài ra, theo Chengping, đa hình rs37972 có liên quan đến nguy cơ mắc hen, những bệnh nhân mang kiểu gen CC và CT có nguy cơ bị hen thấp hơn những bệnh nhân mang kiểu gen TT (OR 0,57; CI 95%, 0,33-0,99) [6]. Tuy nhiên, theo nghiên cứu của Al-Muhsen (2014), alen T lại là yếu tố bảo vệ đối với hen. Những bệnh nhân mang kiểu gen CT và TT lại có nguy cơ bị hen thấp hơn so với nhóm CC (OR 0,67; CI 95%, 0,48-0,94) [4]. Những kết quả không tương đồng này cho thấy tính đa dạng trong bộ gen người, sự đặc trưng riêng của mỗi dân tộc và hen có thể liên quan đến nhiều gen hơn là một. Như vậy, việc khảo sát thêm về mối quan hệ giữa kiểu gen của SNP rs37972 với nguy cơ mắc hen trên dân tộc Việt Nam là rất cần thiết.
Chức năng hô hấp nền của nhóm TT (63,65 ± 14%) bằng với chức năng hô hấp của nhóm CC (63,95 ± 18%) và thấp hơn của nhóm CT (68,17 ± 15%), tuy nhiên, sự khác biệt này không có ý nghĩa thống kê (p=0,495). Chúng tôi ghi nhận kiểu gen rs37972 không liên quan với chức năng hô hấp nền của bệnh nhân. Kết quả này tương tự với nghiên cứu của Chengping, đa hình trên gen GLCCI1 không liên quan đến chức năng hô hấp nền ở bệnh nhân hen [6].
Các bệnh kèm theo cũng ảnh hưởng đến hiệu quả kiểm soát hen, trong đó, tỉ lệ viêm mũi giữa các nhóm gen chênh lệch khá nhiều, tỉ lệ ở nhóm CT (56,4%) và nhóm TT (52,9%) cao hơn nhóm CC (30%) (p=0,075). Khi khảo sát tương quan, chúng tôi ghi nhận giữa kiểu gen của SNP rs37972 và viêm mũi có tương quan với nhau (p=0,044), tuy nhiên mối tương quan này cũng chỉ ở mức yếu (r = 0,211) (Bảng 3). Như vậy, kiểu gen TT và CT có nguy cơ bị viêm mũi cao hơn so với kiểu gen CC (OR 2,9, CI 95%, 1-8,4), điều này có thể là yếu tố gây nhiễu góp phần dẫn đến việc kiểm soát triệu chứng hen kém hơn nhóm CC.
Đối với các bệnh nhân điều trị fluticasone, liều ICS trong cả 3 nhóm gen đều tương đương nhau và đã ở mức cao (trên 500 mcg). Đối với các bệnh nhân điều trị budesonide, liều ICS không khác biệt đáng kể giữa các nhóm, tuy nhiên nhóm CT liều trung bình là 515 mcg và nhóm TT là 542mcg có khuynh hướng cao hơn nhóm CC là 458 mcg (p=0,244). Kết quả này tương đồng với nghiên cứu của Vijverberg [3], bao gồm các bệnh nhi từ 3 nghiên cứu PACMAN [11], PAGES [21], và BREATHE [20] cũng không ghi nhận sự khác biệt về liều ICS giữa các kiểu gen. Tuy nhiên, hen ở trẻ em đa phần chỉ sử dụng ICS liều thấp để kiểm soát, có lẽ vì thế liều ICS giữa các nhóm gen trong nghiên cứu của Vijverberg không khác biệt. Do hạn chế về cỡ mẫu và thiết kế nghiên cứu của chúng tôi chỉ là cắt ngang mô tả, mối liên về liều ICS và kiểu gen rs37972 cần được đánh giá thêm. Hơn nữa, chúng tôi chỉ khảo sát liều ICS hiện tại bệnh nhân đang dùng mà liều này có thể chưa phải là liều tối ưu thực sự giúp kiểm soát hen hoàn toàn đối với mỗi bệnh nhân.
Mối liên hệ giữa kiểu gen rs37972 và mức độ kiểm soát triệu chứng ở bệnh nhân hen có điều trị ICS:
Sau điều trị ICS 3 tháng (n=92) và 6 tháng (n=90), tỉ lệ kiểm soát triệu chứng ở nhóm mang kiểu gen CC cao hơn nhóm mang kiểu gen CT và TT (biểu đồ 1), tuy nhiên sự khác biệt này không có ý nghĩa thống kê. Như vậy đáp ứng ngắn hạn với ICS về triệu chứng không liên quan với kiểu gen rs37972. Kết quả của chúng tôi tương đồng với Vijverberg [11], trong đó, Vijverberg sử dụng thang điểm ACT (Asthma Control Test) và ACQ (Asthma Control Questionnaire) để đánh giá kiểm soát.
Sau 12 tháng điều trị ICS (n=90), tỉ lệ kiểm soát giảm dần theo thứ tự các kiểu gen CC, CT và TT. Trong đó, tỉ lệ kiểm soát ở nhóm CC (75%) cao hơn nhóm TT (50%) khá nhiều (p=0,169) (Biểu đồ 1). Sự khác biệt này rõ rệt hơn khi chỉ khảo sát trong nhóm bệnh nhân không tiếp xúc nghề nghiệp (biểu đồ 2), cụ thể là nhóm mang kiểu gen CC có tỉ lệ kiểm soát chiếm 92,3% cao hơn có ý nghĩa thống kê so với nhóm TT là 41,7% (p=0,011), (OR 16,8; CI 95%, 1,6-174,5) và cũng cao hơn nhiều so với nhóm CT là 63,4% (p=0,079), (OR 6,9; CI 95%, 0,8-58,6).
Mối liên hệ giữa kiểu gen rs37972 với mức độ thay đổi FEV1 ở bệnh nhân hen có điều trị ICS:
Một số yếu tố liên quan đến tắc nghẽn đường thở cố định đã được đề cấp đến như tiếp xúc nghề nghiệp, chưa ngừng tiếp xúc dị ứng nguyên và hút thuốc lá. Nói cách khác, các yếu tố này làm giảm mức độ cải thiện chức năng hô hấp sau điều trị ICS. Chúng tôi khảo sát tương quan giữa các yếu tố này và kiểu gen rs37972 với %FEV1 tăng sau điều trị ICS 3, 6 và 12 tháng (Bảng 4). Trong các yếu tố trên, chỉ có kiểu gen tương quan với đáp ứng ICS sau 6 tháng, ngoài ra không thấy tương quan với mức độ cải thiện chức năng hô hấp sau 3 và 12 tháng. Tương quan giữa kiểu gen với %FEV1 thay đổi sau 6 tháng là tương quan nghịch (p=0,037) , r = - 0,435. Điều đó có nghĩa là khi so sánh giữa nhóm mang kiểu gen CC với nhóm gen CT và TT, %FEV1 cải thiện sau điều trị giảm dần. Mối tương quan này ở mức vừa. Như vậy, nghiên cứu của chúng tôi ghi nhận có sự tương quan giữa kiểu gen rs37972 với đáp ứng ICS về chức năng hô hấp. Kết quả này tương đồng với Tantisira [2] và Chengping [6]. Tuy nhiên, Tantisira và Chengping chỉ đánh giá trong 2 – 3 tháng, không đánh giá lâu hơn 6 – 12 tháng. Do hạn chế về số lượng bệnh nhân có chức năng hô hấp sau 3 tháng nên nghiên cứu của chúng tôi chưa thấy tương quan giữa kiểu gen và đáp ứng ICS sau 3 tháng. Theo khuyến cáo của GINA (2017) [5], chức năng hô hấp cần được đánh giá sau 3 – 6 tháng bắt đầu điều trị kiểm soát để tìm ra chức năng hô hấp tốt nhất của bệnh nhân. Đối với những bệnh nhân đã có triệu chứng hen từ lâu trước khi điều trị ICS, mức cải thiện FEV1 sau điều trị ICS ngắn hạn (3 – 6 tháng) có ý nghĩa quan trọng, quyết định chức năng hô hấp cao nhất của người bệnh. Sau khoảng thời gian đó, chức năng hô hấp không cải thiện nhiều với điều trị hay thậm chí giảm [19].
Sau 3 tháng điều trị ICS, %FEV1 tăng ở nhóm mang kiểu gen CC là 118%, cao hơn nhiều so với nhóm CT và TT là 32% (p=0,051) (Biểu đồ 3). Kết quả này tương đồng với Tantisira [2] và Chengping [6]. Mức độ tăng FEV1 trong các nghiên cứu của Tantisira dao động từ 7,2 – 9,4% thấp hơn nhiều so với nghiên cứu của chúng tôi. Điều này có thể liên quan tới sự khác biệt trong dân số chọn mẫu ban đầu. Chúng tôi đánh giá %FEV1 cải thiện sau 3 tháng điều trị so với kết quả chức năng hô hấp lúc bắt đầu điều trị ICS, nghĩa là các bệnh nhân trong nghiên cứu của chúng tôi hoàn toàn chưa sử dụng ICS trước đó. Tantisira chọn các bệnh nhân từ các nghiên cứu SOCS [12], SLIC [13], LOCCS [16] và Adult Study [9] để bắt đầu đánh giá. Các bệnh nhân này đều đã điều trị ICS trong một thời gian dài trước đó, vì vậy mức độ tăng FEV1 sẽ không nhiều. Sau 6 tháng, mức tăng FEV1 ở nhóm CC là 69,5% cao hơn có ý nghĩa thống kê so với nhóm CT và TT là 30,9% (p=0,006) (Biểu đồ 3). Sau 12 tháng, mức cải thiện FEV1 giảm dần, thấp hơn tại thời điểm 3 tháng và 6 tháng, %FEV1 tăng ở các nhóm hầu như không khác biệt. Hầu hết các bệnh nhân trong nghiên cứu của chúng tôi bắt đầu điều trị ICS khá muộn từ khi có triệu chứng hen nên hiệu quả cải thiện chức năng hô hấp của ICS chỉ rõ ràng tại thời điểm 3 – 6 tháng. Sau thời gian này chức năng hô hấp không tăng thêm nhiều.
Như vậy, đáp ứng với điều trị ICS về chức năng hô hấp giảm dần theo thời gian, %FEV1 tăng nhiều nhất trong 3 – 6 tháng đầu, trong đó nhóm bệnh nhân mang kiểu gen CC cải thiện FEV1 nhiều hơn đáng kể so với nhóm mang kiểu gen CT và TT.
KẾT LUẬN
Đa hình rs37972 trên gen GLCCI1 có 3 kiểu gen: CC, CT và TT chiếm tỉ lệ lần lượt là 21,7%, 59,8% và 18,5%. Tỉ lệ alen T là 48%. Nghiên cứu bước đầu gợi ý có mối liên quan giữa đa hình rs37972 trên gen GLCCI1 và đáp ứng với corticoid hít ở bệnh nhân hen Việt Nam.
HẠN CHẾ CỦA NGHIÊN CỨU
Do tiến hành trong thời gian ngắn, nghiên cứu của chúng tôi bị hạn chế về cỡ mẫu và thiết kế nghiên cứu của chúng tôi chỉ là cắt ngang mô tả. Vì vậy, trong bước đầu khảo sát đa hình gen GLCCI1 trên bệnh nhân hen tại bệnh viện Nhân dân Gia Định, chúng tôi chỉ đạt được mục tiêu xác định tỉ lệ kiểu gen rs37972. Ngoài ra, chúng tôi chưa đánh giá được mối liên hệ giữa kiểu gen rs37972 với mức độ kiểm soát triệu chứng và mức độ cải thiện FEV1 trên bệnh nhân hen có điều trị ICS.
TÀI LIỆU THAM KHẢO
1. Izuhara Y., Matsumoto H., Kanemitsu Y., et al. (2014), "GLCCI1 variant accelerates pulmonary function decline in patients with asthma receiving inhaled corticosteroids". Allergy, 69 (5). 668-673.
2. Tantisira Kelan G., Lasky-Su Jessica, et al. (2011), "Genomewide Association between GLCCI1 and Response to Glucocorticoid Therapy in Asthma". New England Journal of Medicine, 365 (13). 1173-1183.
3. Vijverberg Susanne J.H., Tavendale Roger, Leusink Maarten, et al. (2014), "Pharmacogenetic analysis of GLCCI1 in three north European pediatric asthma populations with a reported use of inhaled corticosteroids". Pharmacogenomics, 15 (6). 799-806.
4. Al-Muhsen Saleh, Vazquez-Tello Alejandro, Jamhawi Amer, et al. (2015), "Rs37972 and rs37973 single-nucleotide polymorphisms in the glucocorticoid-inducible 1 gene are not associated with asthma risk in a Saudi Arabian population". Journal of Asthma, 52 (2). 115-122.
5. GINA (2017), Global Strategy for Asthma Management and Prevention.
6. Hu Chengping, Xun Qiufen, Li Xiaozhao, et al. (2016), "GLCCI1 Variation Is Associated with Asthma Susceptibility and Inhaled Corticosteroid Response in a Chinese Han Population". Archives of Medical Research.
7. Barnes Peter J. (2013), "Corticosteroid resistance in patients with asthma and chronic obstructive pulmonary disease". Journal of Allergy and Clinical Immunology, 131 (3). 636-645.
8. Bateman E.D., Hurd S.S., Barnes P.J., et al. (2008), "Global strategy for asthma management and prevention: GINA executive summary". European respiratory journal, 31 (1). 143-178.
9. Bielory Leonard, Picone Frank, Rabinowitz Paul, et al. (2000), "Multicentre, Randomised, Parallel-Group Study of the Efficacy and Tolerability of Flunisolide Administered Once Daily via AeroChamber® in the Treatment of Mild to Moderate Asthma". Clinical Drug Investigation, 19 (2). 93-101.
10. Drazen Jeffrey M., Silverman Edwin K., Lee Tak H. (2000), "Heterogeneity of therapeutic responses in asthma". British medical bulletin, 56 (4). 1054-1070.
11. Koster Ellen S., Raaijmakers Jan A.M., Koppelman Gerard H., et al. (2009), "Pharmacogenetics of anti-inflammatory treatment in children with asthma: rationale and design of the PACMAN cohort". Pharmacogenomics, 10 (8). 1351-1361.
12. Lazarus Stephen C., Boushey Homer A., Fahy John V., et al. (2001), "Long-acting β2-agonist monotherapy vs continued therapy with inhaled corticosteroids in patients with persistent asthma: a randomized controlled trial". Jama, 285 (20). 2583-2593.
13. Lemanske Jr Robert F., Sorkness Christine A., Mauger Elizabeth A., et al. (2001), "Inhaled corticosteroid reduction and elimination in patients with persistent asthma receiving salmeterol: a randomized controlled trial". Jama, 285 (20). 2594-2603.
14. Lopert Anton (2015), "Association of clinical parameters of asthma treatment outcome in adults with single nucleotide polymorphisms", Univerza v Mariboru (Slovenia).
15. M Adcock Ian, Marwick John, Casolari Paolo, et al. (2010), "Mechanisms of corticosteroid resistance in severe asthma and chronic obstructive pulmonary disease (COPD)". Current pharmaceutical design, 16 (32). 3554-3573.
16. Peters S.P., Anthonisen N., Castro M., et al. (2007), "ALA. American Lung Association Asthma Clinical Research Centers, Randomized comparison of strategies for reducing treatment in mild persistent asthma". N Engl J Med, 356. 2027-39.
17. Peters Stephen P., Ferguson Gary, Deniz Yamo, Reisner Colin (2006), "Uncontrolled asthma: a review of the prevalence, disease burden and options for treatment". Respiratory medicine, 100 (7). 1139-1151.
18. Revathy N., Adithan C., Kumar Vinod, et al. (2017), "Frequency of polymorphic variants in corticotropin releasing hormone receptor 1, glucocorticoid induced 1 and Fc fragment of IgE receptor II genes in healthy and asthmatic Tamilian population". International Journal of Basic & Clinical Pharmacology, 5 (5). 1831-1838.
19. Selroos Olof, Pietinalho Anne, Löfroos Ann-Britt, et al. (1995), "Effect of early vs late intervention with inhaled corticosteroids in asthma". Chest, 108 (5). 1228-1234.
20. Tavendale Roger, Macgregor Donald F., Mukhopadhyay Somnath, et al. (2008), "A polymorphism controlling ORMDL3 expression is associated with asthma that is poorly controlled by current medications". Journal of Allergy and Clinical Immunology, 121 (4). 860-863.
21. Turner Stephen W., Ayres Jon G., Macfarlane Tatiana V., et al. (2010), "A methodology to establish a database to study gene environment interactions for childhood asthma". BMC medical research methodology, 10 (1). 107.