- Chi tiết
-
Được đăng: 15 Tháng 9 2015
Mở đầu: Sinh thiết phổi xuyên phế quản (STPXPQ) là kỹ thuật giúp đạt được chẩn đoán bản chất các tổn thương phổi dạng u ở ngoại biên (bao gồm nốt phổi đơn độc và khối u không có sang thương nhìn thấy khi soi phế quản ống mềm).
Mục tiêu: Đánh giá hiệu quả và tính an toàn của STPXPQ dưới hướng dẫn X quang trong chẩn đoán ung thư phế quản nguyên phát (UTPQ) ở ngoại biên.
Phương pháp: Nghiên cứu tiền cứu trên 62 bệnh nhân được xác định có nốt phổi đơn độc và khối u trên phim chẩn đoán hình ảnh được thực hiện STPXPQ.
Kết quả: 44 bệnh nhân được chẩn đoán ung thư phế quản, 18 bệnh nhân được chẩn đoán tổn thương lành tính. STPXPQ đạt chẩn đoán 62,9%. Riêng với nguyên nhân ác tính, STPXPQ có độc nhạy 65,9%, độc đặc hiệu 100%. Kết quả tốt hơn với các tổn thương có kích thước lớn (độc nhạy trong chẩn đoán nốt phổi đơn độc là 43,8% và khối u là 78,6% với p < 0,05). Vị trí tổn thương (thùy dưới đạt kết quả cao hơn thùy trên) và khoảng cách từ rốn phổi ảnh hưởng nhiều đến kết quả (< 2 cm không đạt được chẩn đoán nào, 4-6 cm đạt kết quả 78,6%). Kỹ thuật tương đối an toàn, không tràn khí màng phổi, chảy máu chỉ gặp 4 trường hợp (6,4%, không cần phẫu thuật).
Kết luận: Hiệu quả của kỹ thuật STPXPQ dưới hướng dẫn X quang chẩn đoán UTPQ ngoại biên phụ thuộc kích thước, vị trí và khoảng cách từ tổn thương đến rốn phổi. Kỹ thuật này tương đối an toàn, ít biến chứng.
Từ khóa: STPXPQ, soi phế quản ống mềm, nốt phổi đơn độc, UTPQ.
ABSTRACT
THE ROLE OF TRANSBRONCHIAL LUNG BIOPSY UNDER FLUOROSCOPIC GUIDEANCE IN THE DIAGNOSIS OF PERIPHERAL SOLITARY PULMONARY NODULES AND MASSES
Ngo The Hoang, Pham Thi Van Thanh, Le Thuong Vu, Tran Van Ngoc
* Y Hoc TP. Ho Chi Minh * Vol. 14 - Supplement of No 1 - 2010: 119 - 127
Background. Transbronchial lung biopsy (TBLB) is a well-recognized diagnostic technique in the investigation of solitary pulmonary nodules (SPN) and peripheral masses (absence of any abnormality in the visible area of fiberoptic bronchoscope).
Objective. To evaluate the efficacy and safety of TBLB in the diagnosis of SPN and peripheral masses, especially diagnosis of lung carcinoma.
Methods. Prospective study was carried out on 62 patients with with chest x-ray finding consistent with SPN and peripheral masses. All of them were underwent bronchoscopy with TBLB.
Results. Forty-four patients suffered from malignant tumors, while 18 patients had nonmalignant lesions. TBLB achieved overall diagnostic sensitivity of 62.9%. Concerning malignant lesions, TBLB had a sensitivity of 65.9%, specificity of 100%. TBLB had a significantly better yield for masses than SPN (sensitivity of 78.6% and 43.8% respectively, p<0.05). The location of the tumor in the bronchopulmonary segment was related to the rate of successful diagnosis from TBLB. No diagnosis was obtained when the lesion was less than 2 cm from the hilum. Complications of TBLB occurred in 4 (6.4%) patients (hemorrhage, not life threatening and not require surgery).
Conclusion. Success in obtaining diagnosis tissue of TBLB was related to location by bronchopulmonary segment, size of the tumor and distance of the tumor from the hilum. This is an accurate and safe technique for the diagnosis of SPN and peripheral masse.
Key words. Transbronchial lung biopsy, bronchoscopy, solitary pulmonary nodule, lung carcinoma
ĐẶT VẤN ĐỀ
Trong thực hành lâm sàng hô hấp, cần phải xác định bản chất của các bóng mờ dạng u ở phổi, trong đó ung thư phế quản nguyên phát (UTPQ) là nguyên nhân ác tính hàng đầu, nếu được chẩn đoán sớm sẽ giúp lựa chọn phương pháp điều trị thích hợp và cải thiện được tỉ lệ sống còn. Bộ ba giúp chẩn đoán gồm lâm sàng - chẩn đoán hình ảnh - soi phế quản ống mềm (SPQOM). Sinh thiết qua SPQOM là kỹ thuật giúp chẩn đoán mô bệnh tin cậy. Tuy nhiên, tỉ lệ chẩn đoán thấp đối với các tổn thương nhỏ ở ngoại biên. Nhằm cải thiện hiệu quả chẩn đoán, kỹ thuật sinh thiết phổi xuyên phế quản (STPXPQ) thường được áp dụng. Nhiều nghiên cứu cho thấy lợi ích của STPXPQ không có hướng dẫn X quang, nhưng với kỹ thuật STPXPQ có hướng dẫn của X quang cần phải có máy chiếu tia X 2 chiều và màn huỳnh quang tăng sáng. Chúng tôi thực hiện nghiên cứu này nhằm xác định giá trị STPXPQ/ X quang chẩn đoán u phổi ngoại biên, đặc biệt chẩn đoán UTPQ.
ĐỐI TƯỢNG - PHƯƠNG PHÁP NGHIÊN CỨU
Thiết kế nghiên cứu
Tiền cứu, cắt ngang, thực hiện từ 1/ 7/ 2007 - 31/ 8/ 2008 tại khoa nội soi bệnh viện Chợ Rẫy.
Tiêu chuẩn nhận bệnh
Bệnh nhân nội trú tại bệnh viện Chợ Rẫy được xác định có u phổi ngoại biên (UPNB, không có sang thương nhìn thấy khi SPQOM) không có BK trong đàm, dịch dạ dày hoặc dịch rửa phế quản.
Tiêu chuẩn loại trừ
Bệnh nhân không đồng ý hoặc đã có chẩn đoán mô học UTPQ và/hoặc ung thư màng phổi hoặc có chống chỉ định của SPQOM.
Tiến hành
Thiết bị và dụng cụ nghiên cứu gồm ống soi phế quản mềm hiệu Olympus FB XT30 dài 550 mm, đường kính ngoài 6,1 mm, đường kính kênh thủ thuật 3,2 mm. Khả năng quan sát 1200, uốn cong 1800 lên phía trên và 1300 xuống phía dưới. Kềm sinh thiết Olympus FB 19C. Nguồn sáng lạnh, hệ thống camera, màn hình, hệ thống máy vi tính để ghi và chụp ảnh đường hô hấp. Máy chiếu tia X hai chiều (C arm) có màn huỳnh quang tăng sáng. Máy hút, máy phun khí dung. Monitor theo dõi huyết áp và SpO2 liên tục. Thuốc và phương tiện cấp cứu gồm adrenalin 0,1%, atropin 0,25 mg, lidocain 2% và 10%, xylocain gel 5%, ventolin spray, diazepam ống 10 mg, glucose 5% và 20%, ôxy tường, ống nội khí quản, bóng ambu.
Khám bệnh nhân trước soi: hỏi tiền sử và bệnh sử kỹ lưỡng, khám lâm sàng hô hấp. Đánh giá các kết quả về hình ảnh học (X quang ngực qui ước thẳng và/hoặc nghiêng và cắt lớp điện toán ngực để xác định vị trí và kích thước của UPNB). Khoảng cách từ rốn phổi được tính từ chỗ chia đôi của động mạch phổi (cùng bên UPNB) đến bờ gần nhất của UPNB trên phim thẳng. Trên phim nghiêng, khoảng cách được tính từ bờ gần nhất của UPNB đến phế quản gốc trái. Khoảng cách lớn nhất trong hai khoảng cách này được dùng để tính khoảng cách từ rốn phổi đến UPNB. Làm các xét nghiệm tiền phẫu thường quy cơ bản (ñông cầm máu, tiểu cầu, nhóm máu, ion ñồ, công thức máu và chức năng thận). Đo khí máu độcng mạch nếu có biểu biện suy hô hấp. Đo điện tim và/hoặc siêu âm tim nếu có yếu tố nguy cơ tim mạch. Khai thác tiền sử chảy máu tự nhiên hay chảy máu liên quan đến các thủ thuật, nếu có phải giải thích nguy cơ chảy máu khi thực hiện STPXPQ.
Chuẩn bị bệnh nhân và tiến hành soi phế quản tương tự như bất kỳ cuộc soi phế quản ống mềm nào.
Kỹ thuật STPXPQ: sau khi xác định được vị trí STPXPQ trên màn tăng sáng, ống soi được đưa ra ngoại biên càng gần tổn thương càng tốt, lặp lại tê tại chỗ để ức chế ho. Giữ ống soi ấn chặt vào vị trí phế quản có tổn thương, trong khi đưa kềm sinh thiết qua kênh thủ thuật. Khi kềm sinh thiết lộ ra ở đầu xa ống soi, đẩy kềm ra xa hơn nữa. Lúc này, theo dõi trên màn tăng sáng và hướng kềm về phía tổn thương. Kiểm tra cả 2 chiều của màn tăng để đảm bảo chính xác vị trí của kềm, mở và đẩy kềm đến gần tổn thương. Lúc này, yêu cầu bệnh nhân hít sâu và cảm giác có đề kháng nhẹ, để an toàn, dưới màn tăng sáng, kềm sinh thiết nên cách màng phổi tạng tối thiểu 5 mm. Sau đó, yêu cầu bệnh nhân thở ra hết và khép kềm lại ở cuối thì thở ra. Hỏi bệnh nhân có cảm giác đau không. Nếu bệnh nhân ra hiệu có đau, mở và rút kềm ra, rồi thực hiện lại ở vị trí lỗ phế quản khác. Ngược lại, nếu bệnh nhân không đau, giữ kềm trong khoảng 6-8 giây rồi rút kềm nhẹ nhàng nhưng dứt khoát. Trong lúc rút kềm, đầu xa ống soi vẫn đặt ở vị trí ấn chặt. Có hai lợi điểm của kỹ thuật này: (1) đầu xa ống soi vẫn ở vị trí tối ưu để tiến hành sinh thiết tiếp mà không cần lấy ống soi ra để lau mặt kính và (2) nếu có chảy máu sau sinh thiết thì vị trí ấn chặt của ống soi sẽ giới hạn máu chảy chỉ ở phân thùy hoặc hạ phân thùy phổi. Nếu không chảy máu, tiến hành sinh thiết tiếp, lấy 3-4 mẫu mô tùy trường hợp. Xử trí chảy máu trong khi thủ thuật: c hảy máu nặng (trên 50 ml, đo bằng hút qua nội soi) xảy ra ngay sau sinh thiết thì giữ đầu xa ống soi ở vị trí ấn chặt và hút liên tục. Nếu chảy máu kéo dài, hút liên tục hay ngắt quãng, đầu xa ống soi vẫn ở vị trí ấn chặt, đồng thời pha 1 ml Adrénalin (0,1%) vào 10 ml nước muối rồi bơm nhẹ nhàng qua ống soi. Nếu chảy máu nặng hay thất bại với cách cầm máu như trên thì tiến hành cấp cứu như một trường hợp xuất huyết đường hô hấp (đặt bóng chèn, áp dụng dán bằng fibrin, hút máu qua ống soi cứng và nêm chặt nội phế quản của phế quản chảy máu, tách riêng cây phế quản bằng ống nội khí quản hai nòng, thuyên tắc mạch và cuối cùng phẫu thuật cắt phân thùy chảy máu).
Sau thủ thuật, kiểm tra không thấy máu chảy, rút nhẹ ống soi và yêu cầu bệnh nhân ho nhẹ xem có chảy máu không. Nếu không, rút ống soi và kết thúc thủ thuật. Kiểm tra dưới màn tăng sáng xem có TKMP? X quang ngực nên thực hiện nếu bệnh nhân ho nhiều, than đau ngực trở lại trong lúc thủ thuật hoặc có biểu hiện triệu chứng hô hấp khác (khó thở, nặng ngực hay đau ngực).
Theo dõi bệnh nhân sau nội soi sinh thiết: sau thủ thuật, bệnh nhân cần được theo dõi tại phòng lưu. Nếu tình trạng ổn định sau 30 phút, bệnh nhân được đưa về khoa và nhịn ăn uống ít nhất 3 giờ để tránh sặc thức ăn vào đường thở. Trường hợp nghi ngờ chảy máu hay tràn khí màng phổi, cần phải theo dõi mạch, huyết áp, nhịp thở, SpO2 và X quang kiểm tra sau 2 giờ. Thực hiện phẫu thuật dẫn lưu khí khoang màng phổi nếu có biến chứng tràn khí màng phổi nặng hoặc phẫu thuật cầm máu khi có chỉ định.
Xử lý mẫu sinh thiết: mẫu mô được ngâm vào dung dịch formol 10% và gởi đến khoa Giải Phẫu Bệnh Lý bệnh viện Chợ Rẫy. Cố định trong 12-24 giờ, sau đó sẽ được khử nước, vùi mô, cắt mỏng và nhuộm để xem xét trên kính hiển vi và được các bác sĩ chuyên khoa Giải Phẫu Bệnh đọc kết quả.
Tiêu chuẩn chẩn đoán
UTPQ khi có bằng chứng mô học ác tính. Lao khi có bằng chứng mô học tổn thương lao đặc hiệu, và/hoặc đáp ứng tốt về lâm sàng và X quang với điều trị lao. Không là chẩn đoán xác định khi kết quả mô học: viêm mãn tính hoặc xơ hóa không đặc hiệu, trừ khi có kết quả mô học xác định sau phẫu thuật, hoặc viêm cấp tính, trừ khi có kết quả mô học xác định sau phẫu thuật hoặc thương tổn biến mất sau điều trị kháng sinh; hoặc viêm mãn tính không đặc hiệu, trừ khi được theo dõi ít nhất 6 tháng-1năm thương tổn biến mất, xơ vôi hoặc không thay đổi kích thước.
Các phương pháp chẩn đoán hỗ trợ khác
Sinh thiết hút xuyên ngực; chọc dò dịch màng phổi và/ hoặc sinh thiết màng phổi; sinh thiết hạch hoặc vị trí di căn; phẫu thuật cắt thùy phổi; theo dõi đáp ứng lâm sàng, X quang và/hoặc cắt lớp điện toán ngực; theo dõi diễn tiến bệnh.
Xử lý và tính toán thống kê
Thu thập số liệu theo biểu mẫu. Xử lý bằng SPSS 10.0. Ngoài thống kê mô tả, tính độ nhạy, độ đặc hiệu, giá trị tiên đoán dương, và giá trị tiên đoán âm theo kích thước và vị trí UPNB. Các phép so sánh và hệ số tương quan được xem là có ý nghĩa thống kê khi p < 0,05.
KẾT QUẢ NGHIÊN CỨU
Đặc điểm dân số nghiên cứu
Giới, tuổi
Từ 01/07/2007 đến 31/08/2008, chúng tôi đã nhận được 62 bệnh nhân tham gia vào nghiên cứu, bao gồm: nam 64,5% (40/62 bệnh nhân), nữ 35,5% (22/62). Tỉ số nam/nữ = 1,8. Tuổi trung bình: 59,9 ± 13,1, thấp nhất 27 tuổi, cao nhất 85 tuổi.
Nguyên nhân UPNB
62 bệnh nhân có UPNB tham gia nghiên cứu đều được STPXPQ dưới hướng dẫn X quang. Kết quả chẩn đoán cuối cùng gồm 18 UPNB lành tính và 44 UPNB ác tính (UTPQ), trong đó ung thư biểu mô tuyến (56,5%) và lao phổi (12,9%) là hai nguyên nhân thường gặp nhất (bảng 1).
Bảng 1: Nguyên nhân UPNB (n = 62; 100%)
|
Lành tính 18 (29%) |
Ác tính 44 (71%) |
||
|
Lao phổi |
8 (12,9) |
Ung thư biểu mô tuyến |
35 (56,5) |
|
Viêm phổi |
4 (6,5) |
Ung thư tế bào vảy |
6 (9,7) |
|
Harmatoma |
2 (3,2) |
Ung thư tế bào lớn |
1 (1,6) |
|
Viêm xơ mãn tính |
2 (3,2) |
Ung thư không xác định tế bào |
2 (3,2) |
|
U sụn |
1 (1,6) |
Ung thư tế bào nhỏ |
0 (0) |
|
Hội chứng Loeffler |
1 (1,6) |
|
|
Hiệu quả STPXPQ dưới hướng dẫn X quang chẩn đoán UTPQ ngoại biên
Theo đường kính tổn thương
Bảng 2: Kết quả STPXPQ dưới hướng dẫn X quang chẩn đoán UTPQ ngoại biên theo đường kính tổn thương
|
Bản chất UPNB |
Đường kính tổn thương (cm) |
Tổng số |
||||
|
Nốt phổi đơn độc (NPĐĐ) |
Khối u ngoại biên (KUNB) |
|||||
|
|
≤ 2 |
2,1 -≤ 3 |
3,1-≤ 4 |
4,1-≤ 6 |
> 6 |
|
|
Lành tính |
4 |
9 |
3 |
2 |
0 |
18 |
|
UTPQ |
6 |
10 |
10 |
14 |
4 |
44 |
|
Sinh thiết (+) |
2 |
5 |
8 |
11 |
3 |
29 |
|
Sinh thiết (-) |
4 |
5 |
2 |
3 |
1 |
15 |
|
Tổng số |
10 |
19 |
13 |
16 |
4 |
62 |
|
29 |
33 |
|||||
Từ kết quả được trình bày trong bảng 2, chúng tôi tính được độ nhạy, độ đặc hiệu, giá trị tiên đoán dương và âm của STPXPQ dưới hướng dẫn X quang trong chẩn đoán UTPQ của UPNB theo thứ tự là 65,9%, 100%, 100%, 54,6%, của NPĐĐ là 43,8%, 100%, 100%, 59,1% và của KUNB là 78,6%, 100%, 100%, 45,5%. Như vậy, khả năng chẩn đoán NPĐĐ ác tính và KUNB ác tính có sự khác biệt có ý nghĩa thống kê (p < 0,05).
Độ nhạy và giá trị tiên đoán âm theo thứ tự đường kính thương tổn ≤ 2 cm là 33,3% và 50%, 2,1- ≤ 3 cm là 50% và 64,3%, 3,1-≤ 4 cm là 80% và 60%, 4,1-≤ 6 cm là 78,6% và 40%, > 6 cm là 75% và 0%. Như vậy, đường kính UPNB càng nhỏ, khả năng đạt được chẩn đoán càng thấp.
Theo vị trí tổn thương
Bảng 3: Kết quả STPXPQ dưới hướng dẫn X quang chẩn đoán UTPQ ngoại biên theo vị trí tổn thương
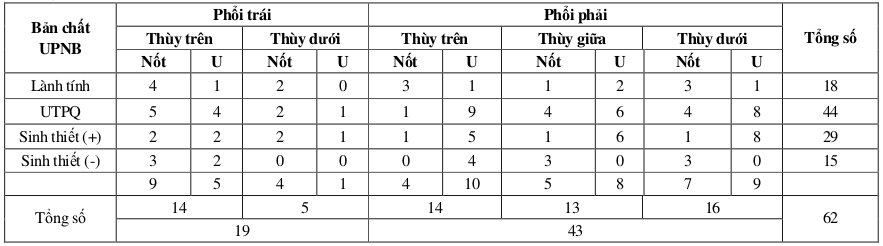
Từ kết quả được trình bày trong bảng 3, chúng tôi tính được độ nhạy, độ đặc hiệu, giá trị tiên đoán dương và âm của STPXPQ dưới hướng dẫn X quang trong chẩn đoán UTPQ ở phổi phải theo thứ tự là 68,8%, 100%, 100%, 52,4%, ở phổi trái là 58,3%, 100%, 100%, 58,3%. Khả năng chẩn đoán UTPQ ngoại biên của STPXPQ dưới hướng dẫn X quang ở phổi phải (68,8%) và trái (58,3%), cũng như NPĐĐ (57,8%) và KUNB (60%) ở phổi trái tương tự nhau (p > 0,05). Nhưng có khác biệt có ý nghĩa trong chẩn đoán NPĐĐ (33,3%) và KUNB (82,6%) ở phổi phải (p < 0,05). STPXPQ dưới hướng dẫn X quang chẩn đoán UTPQ ngoại biên ở thùy dưới cao hơn ở thùy trên, đặc biệt ở phổi trái (100% ở thùy dưới so với 44,4%) (p < 0,05).
Theo khoảng cách từ rốn phổi
Bảng 4: Kết quả STPXPQ dưới hướng dẫn X quang chẩn đoán UTPQ ngoại biên theo khoảng cách từ rốn phổi
|
Khoảng cách từ rốn phổi |
UTPQ n = 44 Sinh thiết (+) (%) |
Sinh thiết (+) (%) |
|
< 2 cm |
4 |
0 (0.) |
|
2-4 cm |
7 |
4 (5,1) |
|
4-6 cm |
14 |
11 (78,6) |
|
> 6 cm |
9 |
5 (55,6) |
|
Không xác định được∗ |
10 |
9 (90) |
∗ Bệnh nhân chỉ có X quang ngực thẳng
Không sinh thiết được trường hợp nào có khoảng cách từ rốn phổi dưới 2 cm. Kết quả sinh thiết tương tự khi khoảng cách từ rốn phổi 2-4 cm (57,1%) và trên 6 cm (55,6%). Đạt kết quả tốt nhất khi khoảng cách này từ 4-6 cm (78,6%).
Biến chứng của STPXPQ dưới hướng dẫn X quang
Bảng 5: Biến chứng SPQOM và STPXPQ dưới hướng dẫn X quang
|
Biến chứng STPXPQ |
N = 62 (100%) |
Xử trí |
|
Chảy máu |
4 (6,4) |
|
|
Nhẹ
|
2 (3,2) |
Cầm máu cơ học |
|
Trung bình |
1 (1,6) |
Cầm máu cơ học + 2 ml Adrenalin 0,1% |
|
Nặng |
1 (1,6) |
Cầm máu cơ học + 4 ml Adrénalin 0,1% |
|
Tràn khí màng phổi |
0 (0) |
|
|
Theo dõi sau STPXPQ |
n = 62 (100%) |
Xử trí |
|
Ho máu |
3 (4,8) |
Nghĩ ngơi + thở oxy |
|
Đau ngực |
4 (6,4) |
X quang phổi kiểm tra. Giảm đau, giảm ho |
Chảy máu lúc sinh thiết xảy ra 4/ 62 (6,4%) trường hợp, xử trí chỉ cầm máu cơ học và thuốc, ngưng chảy máu trong vòng 10 phút. Không có chảy máu trầm trọng cần phải can thiệp qua soi phế quản ống cứng hay ngoại khoa. Không có trường hợp nào có chảy máu tái phát. Không xảy ra biến chứng tràn khí màng phổi. Theo dõi sau STPXPQ: 3/62 (4,8%) trường hợp ho máu nhẹ tự cầm trong ngày và 4/62 trường hợp đau ngực, kiểm tra không phát hiện tràn khí màng phổi. Xử trí chỉ dùng giảm ho và giảm đau thông thường.
BÀN LUẬN
Nguyên nhân UPNB
Kết quả nghiên cứu của chúng tôi, UPNB có bản chất ác tính nhiều hơn lành tính, theo thứ tự 71% và 29%, sự khác biệt này có ý nghĩa thống kê (p < 0,05). Trong đó, chủ yếu là ung thư biểu mô tuyến (56,5%) và lao phổi (12,9%) (bảng 1), tương tự với một số nghiên cứu gần đây(10,15). Đối với UTPQ ngoại biên, kết quả nghiên cứu của chúng tôi cho thấy ung thư loại tế bào tuyến chiếm ưu thế, tương tự với kết quả của các nghiên cứu gần đây(10,11,15). Điều này phù hợp với nhận định UTBMT hiện nay là nhóm có tỉ lệ ngày càng tăng vượt qua nhóm UTTBV và trở thành nhóm ung thư thường gặp nhất ở phổi(5). Tuy nhiên, trong nghiên cứu của chúng tôi không ghi nhận được trường hợp nào UTTBN, có lẽ do mẫu nhỏ và lấy mẫu thuận tiện.
Hiệu quả STPXPQ dưới hướng dẫn X quang trong chẩn đoán UPNB
Một số tác giả cho rằng đối với UPNB, kỹ thuật STPXPQ chưa phải là phương pháp chẩn đoán được lựa chọn đầu tiên do những nghiên cứu trước đây cho thấy độc nhạy của STPXPQ thay đổi từ 31-81%. Lí giải cho sự khác nhau này: (1) tỉ lệ UPNB lành và ác tính thay đổi tùy theo nghiên cứu. Mẫu mô đạt được qua STPXPQ nhỏ chỉ đủ để chẩn đoán mô học đối với các thương tổn ác tính, trong khi các bệnh lý lành tính (viêm mạch, viêm mạn tính, nhồi máu phổi…) thường cần mẫu mô lớn(26); (2) kết quả của kỹ thuật STPXPQ phụ thuộc vào loại tế bào ung thư, vị trí, kích thước của UPNB và số mẫu sinh thiết có thể đạt được trên từng bệnh nhân(2,4,7,23). Nếu không xét đến liên quan đường kính, vị trí và loại thương tổn giải phẫu bệnh lý, kết quả chẩn đoán chung cho cả tổn thương ác tính và lành tính ở ngoại biên trong nghiên cứu của chúng tôi có độ nhạy 59,6%. Như vậy, kết quả nghiên cứu của chúng tôi thấp hơn so với kết quả nghiên cứu của Herth(9) là 76%. Tương tự với kết quả nghiên cứu của Checchani(4) là 57%, của Bilaceroglu(3) là 45%, của Baaklini(2) là 52%, nhưng cao hơn so với kết quả nghiên cứu của tác giả Trần Văn Ngọc(27) là 25%.
Hiệu quả của STPXPQ dưới hướng dẫn X quang trong chẩn đoán UTPQ ngoại biên
Kết quả nghiên cứu của chúng tôi có độc nhạy 65,9%, độ đặc hiệu 100%, giá trị tiên đoán (+) 100%, giá trị tiên đoán (-) 54,6% trong chẩn đoán UTPQ ngoại biên (bảng 2). So với các nghiên cứu STPXPQ dưới hướng dẫn X quang trong chẩn đoán UTPQ ngoại biên trước đây, kết quả của chúng tôi thấp hơn so với kết quả nghiên cứu của FJF. Herth(9) là 77,8%, tương tự kết quả nghiên cứu của Popp(21) là 68,3%, cao hơn so với kết quả nghiên cứu của Trần Văn Ngọc(27) là 55,6%, của Baaklini(2) là 57%, của Bilaceroglu(3) là 49%, của Cortese(7) là 46%, của Milman(17) là 45,5%, của Katis(13) là 38%, của Lam(14) là 21%.
Hiệu quả chẩn đoán UTPQ theo đường kính UPNB
NPĐĐ và KUNB
Với kết quả trình bày trong bảng cho thấy độc nhạy của phương pháp STPXPQ dưới hướng dẫn X quang qua SPQOM trong chẩn đoán UTPQ của các tổn thương phổi ngoại biên dạng NPĐĐ (43,8%) và KUNB (78,6%) trong nghiên cứu của chúng tôi có sự khác biệt có ý nghĩa thống kê (p< 0,05). Kết quả này thấp hơn so với nghiên cứu của Herth(9), chẩn đoán NPĐĐ (57%) và KUNB (89%).
Theo từng nhóm đường kính của NPĐĐ và KUNB
Bảng 2 cho thấy đường kính của UPNB càng lớn, khả năng đạt được chẩn đoán (độc nhạy) trong nghiên cứu của chúng tôi càng cao và giá trị tiên đoán âm càng thấp.
Thống kê của Shah(20), NPĐĐ có đường kính > 2 cm kết quả chẩn đoán là 30-50%, nhưng chưa đến 10% nếu NPĐĐ < 2 cm. Nghiên cứu của Stringfield(25) cho kết quả tốt nhất với thương tổn> 2 cm. Tekavec(26) nhận thấy với NPĐĐ < 2,5 cm kết quả chẩn đoán là 53% và NPĐĐ ≥ 2,5 cm kết quả là 87% (p < 0,05). Theo Cortese(7), đối với tổn thương 2-3,5 cm hiệu quả chẩn đoán là 47%, tổn thương 4-6 cm là 57%, nhưng chỉ 33% đối với tổn thương > 6 cm. Trong nghiên cứu này, tác giả ghi nhận không có trường hợp nào UTPQ ngoại biên có đường kính < 2 cm được chẩn đoán bằng kỹ thuật STPXPQ dưới hướng dẫn X quang. Lam(14) đạt được hiệu quả chẩn đoán với KUNB 3-6 cm là 68% và 82% đối với KUNB > 6 cm. Tương tự, nghiên cứu của Ellis(8), tỉ lệ chẩn đoán là 81% khi tổn thương ác tính khu trú > 4 cm và 58% khi tổn thương ác tính khu trú ≤ 4 cm.
Hiệu quả chẩn đoán UTPQ theo vị trí của UPNB
Kết quả của chúng tôi tương tự với nghiên cứu của Baaklini(2), hiệu quả chẩn đoán là 59% đối với UTPQ ở thùy trên phải, 83% ở thùy giữa, 64% ở thùy dưới phải, 60% ở thùy trên trái và 50% ở thùy dưới trái. Nhưng khác với kết quả nghiên cứu của Cortese(7), hiệu quả chẩn đoán là 31% tổn thương ở thùy trên phải, 38% ở thùy dưới phải, 62% ở thùy trên trái và 57% ở thùy dưới trái. Tác giả cho rằng, hiệu quả chẩn đoán các thương tổn ở thùy trên phải thấp là do khó thực hiện thao tác đưa kềm sinh thiết vào phế quản phân thùy. Ngược lại, Shiner(23), cho rằng các thương tổn ở thùy trên trái rất khó tiếp cận bằng các kỹ thuật xuyên phế quản. Trong khi đó, nghiên cứu của Herth(9) cho thấy, hiệu quả chẩn đoán UTPQ ở thùy trên phải là 89%, thùy trên trái là 82% cao hơn ở thùy giữa là 50% và thùy dưới trái cũng 50%. Nghiên cứu chẩn đoán bản chất các thương tổn phổi ≤ 2 cm, Mori(18), nhận thấy rất khó thực hiện STPXPQ đối với các thương tổn nhỏ ở thùy trên và phân thùy 6. Như vậy, vị trí UPNB ảnh hưởng nhiều đến kết quả, đặc biệt ở thùy trên. Vì khi luồn ống soi lên lấy bệnh phẩm ở phế quản của thùy trên thường khó do ống soi cần phải uốn cong gần như tối đau, nên khi luồn kềm sinh thiết cũng vậy rất khó để đạt được mẫu mô tốt. Chechani(4) khuyến cáo nên cân nhắc đến những phương pháp chẩn đoán khác hơn là SPQOM khi tổn thương ≤ 2 cm, đặc biệt nếu tổn thương có đường bờ rõ và/ hoặc nằm ở phân thùy đáy của thùy dưới và phân thùy đỉnh của thùy trên.
Hiệu quả chẩn đoán UTPQ theo khoảng cách từ rốn phổi đến UPNB
Ngoài đường kính và vị trí của UPNB, hiệu quả chẩn đoán UTPQ của STPXPQ dưới hướng dẫn X quang còn phụ thuộc vào khoảng cách từ rốn phổi đến UPNB. Theo Milman(17), kết quả chẩn đoán của STPXPQ phụ thuộc khoảng cách từ tổn thương đến cựa khí phế quản. Khoảng cách này này càng lớn, hiệu quả chẩn đoán càng giảm (≤ 6 cm là 70%, 6-10 cm là 52% và > 10 cm là 40%, p < 0.02). Cortese(7) STPXPQ đạt được kết quả tốt nhất khi tổn thương ở cách rốn phổi > 5 cm (67%). Nghiên cứu của tác giả không chẩn đoán được trường hợp nào trong 4 UPNB ở cách rốn phổi < 1,5 cm. Stringfield (25) đạt kết quả tốt nhất khi STPXPQ các tổn thương > 2 cm và cách rốn phổi 2-6 cm (71%). Chỉ 25% (1/4) trường hợp tổn thương ở cách rốn phổi > 6 cm được chẩn đoán. Shiner(23) nghiên cứu hiệu quả của SPQOM trong chẩn đoán UPNB, chẩn đoán dương khi thương tổn cách rốn phổi < 4 cm là 80% và chỉ 68% khi thương tổn cách rốn phổi > 4 cm. Baaklini(2), chia phế trường phổi thành 3 vùng hình ellip quanh rốn phổi (1/3 trong, 1/3 giữa và 1/3 ngoài). Tác giả nhận thấy hiệu quả SPQOM trong chẩn đoán UPNB ≤ 2 cm ở 1/3 trong phế trường (14%) thấp hơn so với UPNB ở 1/3 giữa (31%). Tác giả cũng khuyến cáo không nên SPQOM thường qui đối với UPNB < 2 cm ở 1/3 ngoài phế trường. Naidich(19) cho thấy các thương tổn ở 1/3 trong phế trường, nếu có dấu hiệu khí ảnh thì kết quả chẩn đoán sẽ cao hơn so với các thương tổn không có dấu hiệu này.
Nghiên cứu của chúng tôi, chỉ 34/44 trường hợp UTPQ xác định được khoảng cách từ rốn phổi đến tổn thương (10 trường hợp còn lại chỉ có X quang ngực thẳng), kết quả đạt được tương tự với các tác giả trên. Cả 4 trường hợp UPNB cách rốn phổi < 2 cm đều không đạt được chẩn đoán qua STPXPQ dưới hướng dẫn X quang. Khoảng cách từ tổn thương đến rốn phổi 4-6 cm đạt được kết quả cao nhất (78%) (bảng 4).
Biến chứng của STPXPQ dưới hướng dẫn X quang
Khi thực hiện STPXPQ dưới hướng dẫn X quang, các biến chứng xảy ra tương tự như bất kỳ cuộc SPQOM nào bao gồm như: co thắt phế quản, giảm oxy máu, rối loạn cơ học hô hấp, tăng huyết áp rối loạn nhịp tim, sốt và nhiễm khuẩn, tác dụng phụ do thuốc tê...(26,26). Riêng với kỹ thuật STPXPQ, hai biến chứng quan trọng nhất là chảy máu và tràn khí màng phổi.
Chảy máu
Tất cả 62 bệnh nhân đều được thực hiện STPXPQ dưới hướng dẫn X quang qua SPQOM, chúng tôi ghi nhận 6,4% (4/62) trường hợp có biến chứng chảy máu, gồm: 3,2% (2/62) chảy máu nhẹ, 1,6% (1/62) chảy máu trung bình và 1,6% (1/62) chảy máu nặng (bảng 5).
Tai biến chảy máu trong soi phế quản và STPXPQ đã được đề cập trong y văn(1,27,28). Có tác giả đưa ra số trường hợp tử vong do chảy máu trên 50 ml, trong nghiên cứu của chúng tôi không có trường hợp nào. Dự phòng chảy máu trong và sau STPXPQ bằng cách: (1) không sinh thiết ở người có cơ địa chảy máu, (2) duy trì vị trí ấn chặt sau sinh thiết và (3) tránh hút mạnh sau sinh thiết, dù vẫn phải hút nhẹ-ngắn để ñánh giá mức độc máu chảy.
Tràn khí màng phổi
Tràn khí màng phổi do STPXPQ qua SPQOM đã được nhiều tác giả đề cập đến và tỉ lệ cần phải dẫn lưu ngực kín thay đổi tùy nghiên cứu(1,8,23,27,28). Tuy nhiên, trong nghiên cứu của chúng tôi không xảy ra tai biến này.
Villeneuve(28) qua phân tích 22 nghiên cứu tiền cứu (từ 1974-1991) thực hiện STPXPQ trên 4252 bệnh nhân (trong đó có 19 nghiên cứu STPXPQ dưới hướng dẫn X quang), nhận thấy tràn khí màng phổi 4%, chảy máu 2,1% và tử vong 0,1%. Theo thống kê của Smyth(24), STPXPQ dưới hướng dẫn X quang giúp giảm đáng kể tỉ lệ tràn khí màng phổi cần phải dẫn lưu so với khi thực hiện kỹ thuật này không có hướng dẫn X quang. So với sinh thiết hút xuyên ngực (phương pháp được chọn để thay thế STPXPQ trong chẩn đoán UPNB), STPXPQ có độc nhạy thấp hơn nhưng an toàn hơn(29). Các nghiên cứu trước đây cho thấy sinh thiết hút xuyên ngực có độc nhạy thay đổi từ 75-90%(14), nhưng tràn khí màng phổi xảy ra khoảng 20%(22,30).
Theo dõi sau thủ thuật
Nghiên cứu của Ahmad(1), thực hiện STPXPQ dưới hướng dẫn X quang cho 148 bệnh nhân ngoại trú, sau khi kết thúc thủ thuật 1 giờ, ghi nhận có 4 trường hợp phải nhập viện cấp cứu: 2 trường hợp ho máu tự cầm, 1 trường hợp ho máu (> 500 ml) cần phải soi phế quản ống cứng và 1 trường hợp tràn khí màng phổi can thiệp bằng thủ thuật Heimlich.
Trong nghiên cứu của chúng tôi, có 3 trường hợp (4,8%) ho máu sau thủ thuật mà không có biến chứng chảy máu lúc sinh thiết (bảng 5). Lượng máu ít (< 10 ml), xử trí cho bệnh nhân nằm nghĩ tại giường, giảm ho, 1 bệnh nhân phải thở oxy 3 lít/ phút, hết ho máu trong ngày. Chúng tôi cũng ghi nhận có 4 trường hợp (6,4%) đau ngực sau thủ thuật (bảng 5). Các bệnh nhân này đều được chụp X quang phổi kiểm tra, không ghi nhận trường hợp nào có tràn khí màng phổi. Xử trí chủ yếu dùng giảm ho và giảm đau thông thường. Có ý kiến cho rằng có nên chụp X quang ngực thường qui sau STPXPQ hay không? Một nghiên cứu 350 bệnh nhân STPXPQ, chụp X quang ngực sau 2 giờ phát hiện 10 bệnh nhân tràn khí màng phổi, 7 bệnh nhân có triệu chứng. Tác giả kết luận, X quang ngực chỉ thực hiện khi bệnh nhân có triệu chứng(12).
KẾT LUẬN
STPXPQ dưới hướng dẫn X quang chẩn đoán UTPQ ngoại biên có độ nhạy 65,9%, độ đặc hiệu 100%, giá trị tiên đoán (+) 100%, giá trị tiên đoán (-) 54,6%. Hiệu quả chẩn đoán phụ thuộc kích thước tổn thương, vị trí của tổn thương ngoại biên ở từng thùy phổi và khoảng cách từ tổn thương đến rốn phổi. Kỹ thuật này tương đối an toàn, ít biến chứng (chủ yếu chảy máu nhẹ và trung bình), không tràn khí màng phổi, không có tử vong.
Ngô Thế Hoàng*, Phạm Thị Vân Thanh**, Lê Thượng Vũ***, Trần Văn Ngọc***
Hình ảnh: Image courtesy of renjith krishnan at FreeDigitalPhotos.net
TÀI LIỆU THAM KHẢO
1. Ahmad M, Livingston DR, Golish JA, Mehta AC, Wiedemann HP (1986). “The safety of outpatient transbronchial biopsy”, Chest, 90: 403-405.
2. Baaklini WA, Reinoso MA, Gorin AB, Sharafkaneh A, Manian P (2000). “Diagnostic Yield of Fiberoptic Bronchoscopy in Evaluating Solitary Pulmonary Nodules”, Chest, 117: 1049-1054.
3.Bilaceroglu S, Kumcuoglu Z, Alper Hormone, et al (1998). “CT bronchos sign-guided bronchoscopic multiple diagnostic procedure in carcinomatous solitary pulmonary nodules and masses”, Respiration, 65(1): 49-55.
4. Chechani V (1996). “Bronchoscopic diagnosis of solitary pulmonary nodules and lung masses in the absence of endobronchial abnormality”, Chest, 109: 620-625.
5. Chhajed PN, Athavale AU, Shah AC (1999). “Clinical and pathological prifile of 73 patients with lung carcinoma: Is the picture changing?”, J Assoc Physicians, 47(5): 83-487.
6. Chiao CJ, Tang CC, Hui-Chen, et al (2000). “The value of trans-bronchial lung biopsie in the diagnosis of peripheral lung tumors accoding to cell type”, Changgeng Yi Xue Zi, 23(10):584-589.
7. Cortese DA, McDougall JC (1979). “Biopsy and brushing of peripheral lung cancer with fluoroscopic guidance”, Chest, 75 (2): 141-145.
8. Ellis JH (1975). “Transbronchial Lung Biopsy via the Fiberoptic Bronchoscope. Experience with 107 Consecutive Cases and Comparison with Bronchial Brushing”, Chest, 68(4): 523-531.
9. Herth FJF, Ernst A, Becker HD (2002). “Endobronchial ultrasound-guided transbronchial lung biopsy in solitary pulmonary nodules and peripheral lesions”. Eur Respir J; 20, pp. 972–974.
10. Huang HY, Lee YC, Perng RP (2007). “The Factors Affecting the Diagnostic Yield of Fiberoptic. Bronchoscopy in Evaluating Peripheral Solitary Pulmonary Nodules or Masses”, Tzu Chi Med J,19: 21-27.
11. Iyoda A, Suzuki M, Chiyo M, Moriya Y (2003). “A new thin-type bronchoscope improves diagnostic accuracy of peripheral pulmonary carcinoma”, Oncology Reports, 10: 387-389.
12. Izbicki G, Shitrit D, Yarmolovsky A, et al (2006). “Is Routine Chest Radiography After Transbronchial Biopsy Necessary?: A Prospective Study of 350 Cases”, Chest, 129: 1561-1564.
13. Katis K, Inglesos E, Zachariadis E, Palamidas P, Paraskevopoulos I, et al (1995). “The role of transbronchial needle aspiration in the diagnosis of peripheral lung masses or nodules”, Eur Respir J,8: 963-966.
14. Lam WK, So SY, Hsu C, Yu DY (1983). “Fiberoptic bronchoscopy in the diagnosis of bronchial cancer: Comparison of washings, brushings and biopsies in central and peripheral tumors”, Clinical Oncology, 9(1): 35-42.
15. Lê Tiến Dũng (2000). “Ung thư phế quản: một số đặc điểm lâm sàng và vai trò chụp cắt lớp điện toán trong chẩn đoán”, Luận án tiến sĩ y học, Đại học Y Dược TP.HCM.
16. Mark JBD, Marglin SI, Castellino RA (1978). “The role of bronchoscopy and needle aspiration in the diagnosis of peripheral lung masses”, J Thorac Cardiovasc Surg, 76: 266-268.
17. Milman N, Faurschou P, et al (1994). “Transbronchial lungbiopsy through the fibreoptic bronchoscope. Results and complications in 452 examinations”, Respiratory Medicine, 88 (10): 749-753.
18. Mori K, Yanase N, Ono R, Ikeda S (1989). “Diagnosis of peripheral lung cancer in cases of tumors 2 cm or less in size”. Chest; 95, pp. 304-308.
19. Naidich DP, Sussman R, Kutcher WL (1988). “Solitary pulmonary nodules. CT-bronchoscopic correlation”. Chest; 93, pp. 595-598.
20. Pallav LS (2006). The Role of Bronchoscopy in the Diagnosis and the Staging of Lung Cancer. Tumor of the Chest - Biology, Diagnosis and Management. Spinger Berlin Heidelberg; pp. 121-125.
21. Popp W, Rauscher H, Ritschka L (1991). “Diagnostic sensitivity of different techniques in the diagnosis of lung tumors with the flexible fibreoptic bronchoscope. Comparison of brush biopsy, imprint cytology of forceps biopsy, and histology of forceps biopsy”. Cancer; 61, pp. 72-75.
22. Richardson CM, Pointon KS, et al (2002). “Percutaneous lung biopsies: a survey of UK practice based on 5444 biopsies”. British Journal of Radiology; 75, pp. 731–735.
23. Shiner RJ, Rosenman J, Katz I (1988). “Bronchoscopic evaluation of peripheral lung tumours”. Thorax; 43, 887-889.
24. Smyth CM, Stead RJ (2002). “Survey of flexible bronchoscopy in the United Kingdom”. Eur Respir J; 19, pp. 458-463.
25. Stringfield JT, Markowitz DJ, Bentz RR, Welch MH, Weg JG (1977). “The effect of tumor size and location on diagnosis by fiberoptic bronchoscopy”. Chest; 72, pp. 474-476.
26. Tekavec J, Grozdek D (2003). “The Role of Transbronchial Lung Biopsy in the Diagnosis of Solitary Pulmonary Nodule”. Coll. Antropol; 27 (2) pp. 669-675.
27. Trần Văn Ngọc (1999). “Sinh thiết phế quản và xuyên phế quản qua soi phế quản ống mềm trong chẩn đoán bệnh lý hô hấp”, Luận án tiến sĩ y học, Đại học Y Dược TPHCM.
28. Villeneuve MB, Kval P (1997). Transbronchial lung biopsy. Textbook of Fiberoptic Bronchoscopy, Philadelphia; pp. 58-83.
29. Wahidi MM, Rocha AT, Hollingsworth JW, et al (2005). “Contraindications and Safety of Transbronchial Lung Biopsy via Flexible Bronchoscopy”. Respiration; 72, pp. 285–295.
30. Westcott JL (1998). “Percutaneous Transthoracic Needle Biopsy”. Radiology; 169, pp. 593-601