- Chi tiết
-
Được đăng: 09 Tháng 2 2019
BSCK 2 NGUYỄN ĐÌNH DUY- BV PHẠM NGỌC THẠCH
LỜI GIỚI THIỆU
COPD là một bệnh lý trầm trọng , là gánh nặng cho cộng đồng và cho từng cá thể bệnh nhân, có tỷ lệ tử vong đứng hàng thứ 3 trong nguyên nhân gây tử vong của các bệnh lý trên thế giới.
Mục tiêu điều trị bệnh nhân bệnh phổi tắc nghẽn mạn tính (COPD) là giúp làm giảm các triệu chứng và giảm nguy cơ đợt cấp, trong đó thuốc giản phế quản có vai trò rất lớn trong cải thiện chất lượng cuộc sống và hạn chế sự tiến triển của bệnh.
Cơ chế tác dụng và các thực nghiệm lâm sàng đã chứng minh phối hợp các thuốc giãn phế quản bao gồm thuốc tác dụng vận β2-agonist tác dụng kéo dài (LABA) và thuốc tác dụng kháng Muscarinic tác dụng kéo dài (LAMAs) làm tăng hiệu quả so với sử dụng phương thức đơn trị đặc biệt trong hạn chế đợt kịch phát và cải thiện chức năng phổi
THUỐC CƯỜNG b2
Isoprenaline tổng hợp về mặt hóa học được giới thiệu vào năm 1948, trong khi b2-agonist chọn lọc, salbutamol (albuterol) được giới thiệu như một thuốc giãn phế quản vào năm 1969, tiếp theo là terbutaline năm 1974. Các thuốc giãn phế quản đồng vận b kéo dài (Long active bronchodilatator action, LABA) salmeterol và formoterol trở thành thuốc có sẵn trong thực hành lâm sàng từ những năm 1990, thời gian tác dụng 12 giờ /một lần. ULTRA-LABA (LABA cho sử dụng một lần mỗi ngày) như indacaterol, vilanterol và olodaterol gần đây đã được phê duyệt và đưa vào sử dụng.
Sự kích thích các thụ thể β2-adrenergic bởi các chất đồng vận gây ra giãn phế quản. Các thụ thể này được tìm thấy trên bề mặt màng tế bào cơ trơn của đường hô hấp. Mổi tế bào cơ trơn chứa từ từ 30-40,000 thụ thể β2, phân phối từ khí quản đến phế quản tận cùng với mật độ càng nhiều khi đường kính phế quản càng nhỏ. do đó, các chất β2-Agonist, gây ra sự giãn của các phế quản nhỏ (<2 mm đường kính) [16].
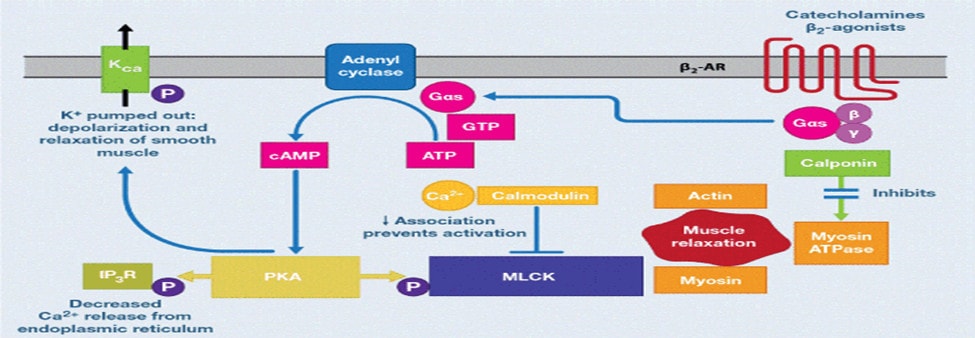
Tác động lên thụ thể β2 bằng dẫn truyền thần kinh (catecholamine hoặc β2-agonist) dẫn đến sự hoạt hóa của adenylyl cyclase, qua kích thích G-protein (Gs), xúc tác chuyển đổi adenosine triphosphate (ATP) thành cyclic adenosine monophosphate cAMP [17] ]. Chính cAMP trong tế bào cơ trơn hoạt hóa protein kinase A (PKA), trong đó phosphoryl hóa một số protein đích trong tế bào. Khi PKA phosphoryl hoá men Myosin light chain kinases (MLCK) làm cho ái lực Calmodulin / Ca+ giảm, và sự giãn cơ xảy ra (Hình 1). Ngoài ra, thụ thể triphosphate inositol (IP3R) trong lưới nội chất (ER) được phosphoryl hóa bởi PKA, làm giảm sự giải phóng canxi từ ER đến cytosol, làm giảm sự sẵn có của canxi trong tế bào chất, gây giảm sự tương tác giảm Calmodulin / Ca+ với MLCK. Ngoài ra, PKA có thể phosphoryl hoá các kênh Kali, đẩy Kali ra khỏi tế bào, làm khử cực và làm giãn cơ trơn. Với những cơ chế này, thông qua cAMP / PKA, tạo ra sự giãn cơ trơn phế quản [20]
Clin Res Trials, 2017
Vì thụ thể b2 khu trú trên nhiều tế bào khác nhau trong đường hô hấp nên b2-agonist có thể có tác dụng khác trên đường dẩn khí, do đó chúng có thể làm giãn phế quản gián tiếp bằng cách ức chế sự giải phóng các chất trung gian phế quản từ các tế bào viêm và dẫn truyền thần kinh từ các dây thần kinh đường hô hấp. Ví dụ, β2-agonist ức chế sự giải phóng các chất trung gian của mastocyte thông qua việc ngăn chặn sự dẫn truyền trung gian Calcium qua kênh K (KCa3.1) Tác dụng ức chế giải phóng trung gian tế bào mast và thẩm thấu vi mạch là tác dụng kháng viêm, tuy nhiên tác dụng này chỉ có hiệu quả trong viêm cấp tính hơn là trong quá trình viêm mãn tính, trái ngược với tác dụng kháng viêm khi sử dụng Corticoid dạng hít (ICS) .Nguyên nhân là do các thụ thể b2 ít hiện diện trên các đại thực bào, tế bào lympho, tế bào ái toan, hơn nữa các thụ thể này còn bị bất hoạt bởi men G-protein receptor kinase-2 (GPCK2). [18]
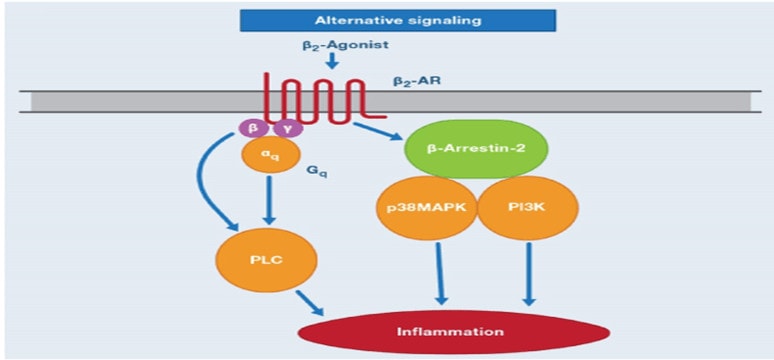
Mặt khác, mặc dù thụ thể β2- kết hợp với G protein (Gs) để giãn cơ trơn phế quản, nhưng có thể kích hoạt các cơ chế khác gây tác dụng có hại như tăng hiện tượng viêm. Khi β2 biểu hiện quá mức xảy ra như trong bệnh hen suyễn,Gq kết hợp với phospholipase Cβ1 (PLCβ1), được hoạt hoá, dẫn đến làm tăng phản ứng co thắt phế quản qua các chất trung gian như ACh và histamine. Các thụ thể B2 còn tương tác với b-aressting 2, chất này lại tác động hổ trợ với các chất p38MAPK và PI3K là những chất trung gian tiền viêm gây phản ứng có hại đặc biệt là trong hen [19]
Clin Res Trials, 2017
THUỐC KHÁNG CHOLINERGIC
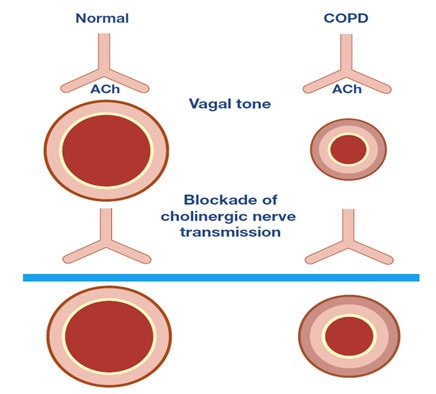
Các thụ thể muscarinic được chia thành các phân nhóm. Các thụ thể M1, M2 và M3 được tìm thấy trong đường hô hấp của con người, M4 và M5 nằm trong hệ thần kinh trung ương. Các thụ thể M1 được tìm thấy trong thành phế nang và trong hạch giao cảm, ức chế tác dụng của chúng làm giảm phản ứng co thắt phế quản. Các thụ thể M2 nằm trên đoạn cuối dây thần kinh 10 sau hạch, và các thụ thể này giới hạn hoạt động thần kinh phế vị gây sự co thắt phế quản. Khi giải phóng và vận chuyển của Acheyl cholin tăng lên (gây co thắt phế quản), các thụ thể này ức chế sự giải phóng của Acetyl cholin qua quá trình trao đổi chất dẩn truyền thần kinh. Nếu các thụ thể này bị bất hoạt, cơ chế điều khiển phế vị mất đi, làm kéo dài sự co thắt của cơ trơn phế quản. Các thụ thể M3 khu trú trong cơ trơn đường dẩn khí và các tuyến dưới niêm mạc, nơi chúng làm trung gian gây co thắt phế quản và tăng tiết nhầy, được kích thích bởi thuốc chủ vận Acetyl cholin hoặc cholinergic (ví dụ methacholine). Các sợi cholinergic tập trung nhiều trong vùng rốn phổi và giảm về phía đường hô hấp ngoại vi, tương tự các thụ thể cholinergic muscarinic cũng làm giảm mật độ của chúng trong các đường dẩn khí ngoại biên (chủ yếu là các thụ thể M3), ngược lại với thụ thể β2. Các thụ thể Muscarinic Ach là các thụ thể ghép protein G(GPCRs). Các thụ thể M1 và M3 được kết hợp với các protein Gq, trong khi M2 cùng với protein Gio. Khi receptor được kích hoạt, Guanosine triphosphate (GTP) gắn với tiểu đơn vị G-protein tương ứng (ví dụ Gq trong trường hợp M3), kích thích phospholipase Cβ (PLCβ). PLCβ phân tách Phosphoinositol bisphosphate (PIP2) thành Inositol triphosphate (IP3) và Diacyl glycerol (DAG). IP3 tương tác với các thụ thể tương ứng (IP3R) trong lưới nội chất (ER) và gây ra sự giải phóng canxi vào tế bào chất, liên kết với Calmodulin bằng cách kích hoạt MLCK. Các MLCK phosphoryl hoá Myosin tạo điều kiện cho sự tương tác giữa actin và myosin gây co cơ. DAG lần lượt kích hoạt protein kinase C (PKC) làm phosphoryl hoá calponin, ngăn cản sự ức chế của nó trên Myosin-ATPase (thể hoạt động Myosin ATPase gây co cơ).Tất cả các kháng cholinergic muscarinic khống chế thụ thể cholinergic ngăn chặn các quá trình co cơ mô tả ở trên và do đó đươc xem là chất đối kháng. [17]
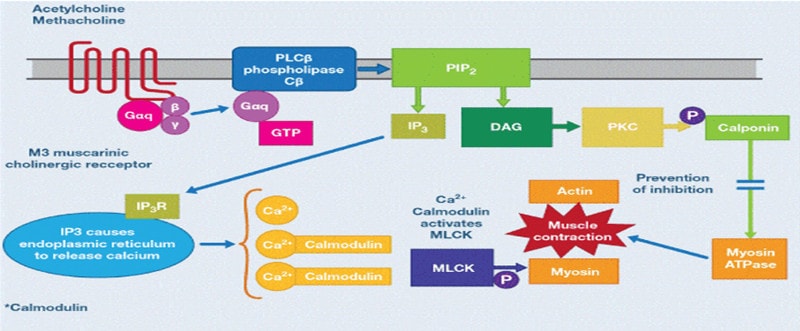
Clin Res Trials, 2017
Các nghiên cứu in vitro cho thấy Acetylcholin gây ra sự giải phóng các chất trung gian gây viêm như GM- CSF (granulocyte-macrophage colony stimulating factor), leukotriene B4 (LTB4) và Prostaglandin E2 của các tế bào biểu mô. được giải phóng qua trung gian thông qua các thụ thể muscarinic có thể bị ức chế bởi Tiotropium. [11]
Glycopyrronium bromide đã làm giảm sự biểu hiện của các chất trung gian gây viêm trong dung dịch rửa phế quản (BALF) trên đối tượng bệnh nhân hút thuốc lá [15]
Xơ hoá quanh phế quản có thể là yếu tố quan trọng trong sự suy giảm FEV1 trong COPD. Gần đây, aclidinium đã được chứng minh là ức chế sự chuyển đổi của nguyên bào sợi sang nguyên bào sợi cơ,làm giảm sự tái cấu trúc cơ trơn. [13]. Vì vậy,cho thấy có bằng chứng thuốc kháng cholinergic có thể ngăn ngừa sự co thắt và tăng sinh của các tế bào cơ trơn và nguyên bào sợi trong quá trình tái cấu trúc đường dẩn khí . Qua đó cũng cho thấy LAMA có thể có lợi ích khi sử dụng điều trị duy trì trong hen phế quảnvà COPD, đặc biệt ở những người không đạt được sự kiểm soát với phối hợp LAMA- ICS hoặc ở những người thường xuyên có cơn kịch phát [14]
ĐIỀU TRỊ PHỐI HỢP HAI LOẠI THUỐC GIÃN PHẾ QUẢN
Sự kết hợp của β2-adrenergic với Kháng cholinergic trong điều trị các bệnh đường hô hấp tắc nghẽn dựa trên một số yếu tố. Ở mức độ cơ chế tác dụng, sự kết hợp 2 nhóm thuốc có tác dụng bổ sung cho nhau. Sự phân bố chủ yếu của các thụ thể Cholinergic tạo điều kiện cho sự giãn phế quản vùng trung tâm của thuốc kháng cholinergic và tác dụng của β2-agonist ở ngoại vi nơi thụ thể β2 tập trung nhiều nhất. Đây là một cơ chế trong đó một thuốc giãn phế quản này tạo điều kiện tiếp cận và tác dụng cho thuốc giãn phế quản khác. Một sai lầm phổ biến hiện nay khi cho rằng anticholinergics và β2-adrenergics có tác dụng cộng hợp. Sự cộng hợp chỉ xảy ra khi hai loại thuốc hoạt động trên cùng một thụ thể và kết quả của sự phối hợp này đơn giản là tổng tuyến tính của hai loại thuốc này, để đạt được hiệu quả tối đa.
Tác dụng của 2 nhóm thuốc giãn phế quản trên 2 thụ thể khác nhau có hiệu quả hổ trợ khi tác động trên cùng một mô đích (cơ trơn) và hiệu quả phối hợp này lớn hơn tổng của hiệu quả từng thuốc riêng lẽ, trong trường hợp này là sự giãn phế quản.
Ví dụ, β2-adrenergic khi hình thành cAMP và nó kích hoạt PKA (phosphorylates IP3R) ức chế sự giải phóng canxi từ ER. Đồng thời, các kháng cholinergic, bằng cách ngăn chặn sự hình thành của PLCβ (và ức chế sự hình thành của IP3 là chất dẩn truyền thứ hai kích thích IP3R) ngăn chặn việc phóng thích canxi từ ER. Rõ ràng là hoạt động thông qua các con đường chuyển hóa khác nhau của mỗi thụ thể, kết quả cuối cùng là giảm sự nồng độ của canxi trong cytosol, đó là nền tảng cho các hoạt động phối hợp của actin và myosin trong quá trình của sự co cơ. Một ví dụ khác là hoạt động của cả hai thuốc giãn phế quản trên calponin, trong khi kích thích β2- adrenergic làm tăng nồng độ của Caponin trong cytosol và thuốc kháng cholinergic ngăn chặn calponin bằng cách bất hoạt nó bằng PKC. Kết quả cuối cùng là tăng giải phóng của enzyme ức chế Myosin ATPase và do đó làm giãn cơ . Ngoài ra hoạt động giao cảm xảy ra chủ yếu vào ban ngày, trong khi hệ thống đối giao cảm là hoạt động vào ban đêm, do đó phối hợp cả hai nhóm có thể cung cấp nhiều lợi ích hơn so với 1 nhóm riêng lẽ [10]
Trong điều trị cơn kịch phát COPD, giống như trong cơn kịch phát hen, việc sử dụng SAMA là một lựa chọn và không bắt buộc. Việc sử dụng SABA có hoặc không có Kháng cholinergic là thuốc giãn phế quản ban đầu để điều trị [12]
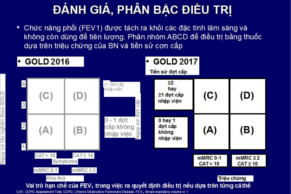
Khuyến cáo bệnh nhân tiếp tục điều trị duy trì với LABA và / hoặc LAMA, hoặc kết hợp và có hoặc không có ICS, hoặc nếu không có điều trị trước đó, nên áp dụng trước khi xuất viện. Thuốc giãn phế quản tác dụng ngắn "PRN" sử dụng khi cần, chỉ được chỉ định trong nhóm A trong phân loại của (GOLD). Từ nhóm B đến D, khuyến cáo sử dụng các thuốc giãn phế quản tác dụng kéo dài có hiệu quả hơn so với các thuốc giãn phế quản tác dụng ngắn được sử dụng khi cần thiết (prn)[1].
PHỐI HỢP LAMA/LABA TRONG COPD
Ngoài hiệu quả các thuốc giãn phế quản có thể thu được từ sự phối hợp LABA / LAMA, sự ra đời của các dụng cụ mới cho phép phối hợp cả hai loại thuốc , do vậy thuốc có thể được phân phối một lần trong ngày, tạo điều kiện cho việc tuân thủ điều trị, làm giảm liều mỗi lọai thuốc và do vậy sẽ giảm tác dụng phụ của thuốc khi sữ dụng thuốc đơn trị liều cao. Trong một thập kỷ qua, chỉ có LAMA tiotropium bromide được sử dụng trên lâm sàng. Các nghiên cứu lớn như UPFLIT, TIOSPIR..đã chứng minh vai trò của Tiotropium trong cải thiện chức năng phổi trong giai đoạn sớm của COPD.
Từ năm 2012, việc điều trị COPD có bước ngoặc mới khi có thuốc LAMA mới: glycopyrronium bromide và aclidinium bromide và umeclidinium. Ba loại thuốc này được coi là lựa chọn điều trị trong bản cập nhật GOLD gần đây. Glycoyrronium bromide là một hợp chất tổng hợp amonium bậc bốn, gần đây được cải tiến thành dạng bột khô để sử dụng đường hít một lần một ngày. Các nghiên cứu tiền lâm sàng hiệu quả của glycopyrronium bromide trong COPD (GLOW) đã được tiến hành. Các nghiên cứu cho thấy 50 μg hít một lần mỗi ngày cải thiện FEV1, khó thở và tình trạng sức khỏe [5] [6] cũng như sự giảm số lượng AECOPD cũng được ghi nhận [ 7 ]
Glycopyrronium có tính an toàn chấp nhận được, nhất là tỷ lệ thấp của về tác dụng phụ trên hệ tim mạch . Aclidinium bromide đã được chấp thuận tại Liên minh châu Âu (EU) và ở Mỹ trong điều trị duy trì COPD. Trong các nghiên cứu pha III, Aclidinium bromide (so với giả dược) cải thiện chức năng phổi, khó thở và tình trạng sức khỏe trong 24 tuần điều trị đầu tiên và cải thiện này được duy trì trong 52 tuần trong các nghiên cứu tiếp theo. Tần suất xuất hiện của AECOPD giảm đáng kể so với giả dược, và có tính an toàn cao về tác dụng trên hệ tim mạch Aclidinium (400 μg DPI, 400 μg pMDI) được dùng hai lần mỗi ngày trong khi umeclidinium (62,5 μg DPI) được dùng mỗi ngày một lần.
LABA, salmeterol (25-50 μg MDI và DPI) và formoterol (4,5-9 μg DPI) được sử dụng 12 giờ một lần, dùng trong như một loại thuốc duy nhất trong một thiết bị hoặc phối với steroid hoặc LAMA. ULTRA-LABA (indacaterol, olodaterol và vilanterol)có thể dùng riêng lẽ hay được phối hợp với LAMA trong một thiết bị duy nhất sử dụng trong 24 giờ. Indacaterol là ULTRA-LABA đầu tiên được phê duyệt để được kê đơn một lần mỗi ngày trong COPD. là thuốc đã được chứng minh là có tác dụng giãn phế quản lớn hơn LABA, formoterol (12 μg hai lần mỗi ngày), và hiệu quả tương tự như tiotropium [9].
Ủy ban châu Âu cũng như FDA đã công nhận, Olodaterol, thuốc giãn phế quản tác dụng kéo dài (2,5-5 μg SMI = hít sương mù), là thuốc để điều trị COPD nhẹ đến nặng, cũng như Vilanterol (25 μg) mỗi ngày một lần [4].
Phối hợp một thuốc giãn phế quản thứ hai cho bệnh nhân có triệu chứng không được kiểm soát với đơn trị liệu giúp cải thiện chức năng phổi, triệu chứng và tình trạng sức khỏe, mà không làm tăng nguy cơ tác dụng phụ. được chứng minh trong nghiên cứu INTRUST-1 và INTRUST-2 (Indacaterol cộng với Tiotropium so với Tiotropium đơn trị) và trong GLOW6 (Indacaterol cộng với glycoyrronium so với indacaterol). Ngoài ra, việc sử dụng phối hợp 150 μg indacaterol cộng với 50 μg glycopyrronium được chứng minh là cao hơn so với đơn điều trị. Nghiên cứu SPARK đã đánh giá hiệu quả điều trị bằng kết hợp 2 loại thuốc giãn phế quản dạng hít tác dụng kéo dài ở COPD trung bình đến nặng. Các bệnh nhân đang điều trị chia ngẫu nhiên 3 nhóm bệnh nhân, nhóm điều trị kết hợp của 110 μg indacaterol cộng với 50 μg glycopyrronium, nhóm sử dụng glycopyrronium 50 μg đơn trị và nhóm tiotropium 18 μg (nhãn mở). Kết quả nghiên cứu cho thấy rằng nhóm sử dụng giãn phế quản kép là vượt trội trong việc ngăn ngừa AECOPD từ vừa đến nặng so với nhóm LAMA đơn trị .[2]
GOLD khuyến cáo sử dụng kết hợp LABA / LAMA từ nhóm B của phân loại COPD trong một số trường hợp nhất định. Nếu bệnh nhân vẫn còn khó thở khi sử dụng đơn trị liệu, việc sử dụng hai thuốc giãn phế quản được khuyến cáo. Có thể sử dụng liệu pháp thuốc giãn phế quản kép nếu bệnh nhân khó thở nhiều ngay từ đầu, và hạ bậc dùng đơn trị liệu nếu các triệu chứng không cải thiện với sự kết hợp thuốc. Nhóm C, thậm chí trong nhóm D với nhiều cơn kịch phát thì sử dụng thuốc kết hợp kép như là một thay thế cho liệu pháp LABA / ICS, đặc biệt là kể từ khi có nhiều bằng chứng cho thấy ICS làm tăng nguy cơ viêm phổi.[1]
Trong việc chuyễn đổi từ các liệu pháp điều trị khác sang dạng phối hợp LAMA/LABA, qua các nghiên cứu như nghiên cứu CRYSTAL, FLASH [8] cho thấy tính hiệu quả của liệu pháp sử dụng kép thuốc giãn phế quản trong cải thiện chức năng phổi và triệu chứng khó thở tốt hơn khi được chuyễn đổi từ nhóm LABA, LAMA, ICS/LABA.
Trong nghiên cứu DACCORD, việc chuyễn đổi liệu pháp ICS/ LABA hay ICS/LABA/LAMA sang LABA/ LAMA cũng cho kết quả khả quan. Sau 1 năm theo dỏi thì nhóm LABA/LAMA chuyễn từ ICS/LABA có tần xuất cơn kịch phát thấp hơn liệu pháp điều trị ban đầu (14% so với 32%), nhóm LABA/ LAMA chuyễn từ ICS/LABA/LAMA thỉ tần xuất cơn kịch phát không thay đổi so với liệu pháp ban đầu [3]
KẾT LUẬN
Thuốc giãn phế quản kháng Muscarinic và Cường b2 Adrenergic tác dụng kéo dài (LAMA LABA), được sử dụng phối hợp, có tác dụng bổ sung cho nhau để có thể tối ưu hóa giãn phế quản của đường hô hấp, phòng ngừa cơn kịch phát.
Sự phối hợp có thể được sử dụng trong đợt cấp của các bệnh lý tắc nghẽn và như là liệu pháp cứu trợ bằng các thuốc giãn phế quản tác dụng ngắn (SABA / SAMA).
Các thuốc giãn phế quản tác dụng kéo dài (LABA, ULTRA-LABA và LAMA) được sử dụng trong các thiết bị riêng biệt hoặc trong cùng một thiết bị đều hiệu quả và là một liệu pháp được chấp nhận trong điều trị duy trì trong COPD.
LAMA/LABA là liệu pháp chọn lựa trong phương thức hạ bậc điều trị COPD.
TÀI LIỆU THAM KHẢO
1. GOLD (2017) Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. Global Initiative for Chronic Obstructive Lung Disease.
2. Wedzicha JA, Decramer M, Ficker JH; Niewoehner DE, Sandstrom T, et al (2013) Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 compared with glycopyrronium and tiotropium (SPARK). A randomized, double-blind, parallel-group study. Lancet Respir Med 1: 199-209.
3. Worth et al. Respir Med 2017; 131:77–84.
4. Koch A, Pizzichini E, Hamilton A, Hart L, Korducki L, et al. (2014) Lung function e cacy and symptomatic bene t of olodaterol once daily delivered via Respimat® versus placebo and formoterol twice daily in patients with GOLD 2-4 COPD: results from two replicates 48-week studies. Int J Chron Obstruct Pulmon Dis 9: 697-714.
5 . D’Urzo A, Ferguson GT, van Noord JA, Hirata K, Martin C, et al. (2011) E cacy and safety of once-daily NVA237 in patients with moderate-to-severe COPD: the GLOW1 trial. Respir Res 12: 156 .
6. Beeh KM, Singh D, Di Scala L, Drollmann A (2012) Once-daily NVA237 improves exercise tolerance from the rst dose in patients with COPD: the GLOW 3 trial: Int J Chron Obstruct Pulmon Dis
7. Kerwin E, Hébert J, Gallagher N, Martin C, Overend T, et al. (2012) E cacy and safety of NVA237 versus placebo and tiotropium in patients with COPD: the GLOW2 study. Eur Respir J 40: 1106-1114
8. Ref 21. Peter Frith et al.: THE FLASH STUDY, Congress of the Asian Pacific Society of Respirology, Volume 22, Issue S3 November 2017
9. Dhal R, Chung KF, Buhl HR, Magnussen H, Nonikov V, et al. (2010) E cacy of a new once-daily long-acting inhaled beta2-agonist indacaterol versus twice-daily formoterol in COPD. Thorax 65: 473-478
10. Alvarado-Gonzalez A, Arce I (2015) Tiotropium Bromide in Chronic Obstructive Pulmonary Disease and Bronchial Asthma
11. Bos IS, Gosens R, Zuidhof AB, Schaafsma D, Halayko AJ, et al. (2007) Inhibition of allergen-induced airway remodelling by tiotropium and budesonide: a comparison. Eur Respir J 30: 653-661
12. National Institute for Health and Care Excellence (2010) Chronic obstructive pulmonary disease in over 16s: diagnosis and management.
13. Milara J, Serrano A, Peiró T, Gavaldà A, Miralpeix M, et al. (2012) Aclidinium inhibits human lung fibroblast to myofibroblast transition
14. Price D, Fromer L, Kaplan A, van der Molen T, Román-Rodríguez M (2014) Is there a rationale and role for long-acting anticholinergic bronchodilators in asthma? Prim Care Respir Med 24: 1-9
15. Shen LL, Liu YN, Shen HJ, Wen C, Jia YL, et al. (2014) Inhalation of glycopyrronium inhibits cigarette smoke-induced acute lung in ammation in a murine model of COPD. Int Immunopharmacol 18: 358-364.
16. Johnson M (2001) Beta2-adrenoceptors: mechanisms of action of beta2-agonists. Paediatr Respir Rev 2: 57-62
17. Barnes PJ (2011) Biochemical basis of asthma therapy. J Biol Chem 286: 32899-32905
Wessler I, Kirkpatrick CJ (2008) Acetylcholine beyond neurons: the non-neuronal cholinergic system in humans. Br J Pharmacol 154: 1558-1571.
18. Howarth PH, Beckett P, Dahl R (2000) The effect of long-acting beta2-agonists on airway inflammation in asthmatic patients. Respir Med 94 Suppl F: S22-25.
19. Schmid CL, Bohn LM (2009) Physiological and pharmacological implications of beta- arrestin regulation. Pharmacol Ther 121: 285-293 .
20. Barnes PJ (2011) Biochemical basis of asthma therapy. J Biol Chem 286: 32899-3290