- Chi tiết
-
Được đăng: 16 Tháng 11 2017
Tóm tắt
COPD thường hay đi kèm với các bệnh lý khác (bệnh đồng mắc) như bệnh tim mạch, ung thư phổi, sụt cân, loãng xương và đái tháo đường... Tần suất của các bệnh lý đồng mắc sai biệt nhau giữa các nghiên cứu do cách đánh giá, chẩn đoán và phân bố dân số nghiên cứu khác nhau, nhưng phần lớn cho thấy phổ biến nhất là các bệnh tim mạch, trong đó đứng đầu là suy tim mạn.
Bệnh tim mạch là bệnh đồng mắc thường xuyên và quan trọng trong COPD, có liên quan đến tiên lượng xấu, nhiều triệu chứng và khả năng gắng sức kém hơn nên cần được chú ý phát hiện, đánh giá và có những biện pháp điều trị thích hợp. Trong thực hành lâm sàng nên hiểu rõ ảnh hưởng của các thuốc điều trị COPD trên bệnh tim mạch cũng như ảnh hưởng của các thuốc tim mạch đối với bệnh COPD để có chọn lựa thuốc thích hợp.
Bệnh nhân COPD có nguy cơ mắc ung thư phổi cao hơn so với người có chức năng hô hấp bình thường. Chẩn đoán và điều trị ung thư phổi ở bệnh nhân COPD gặp ít nhiều khó khăn do các kỹ thuật chẩn đoán và điều trị thường khó thực hiện ở bệnh nhân COPD có mức độ tắc nghẽn vừa và nặng vì nguy cơ biến chứng cao.
Tăng tần suất loãng xương ở bệnh nhân COPD là 14,8% so với 10,8% trong dân số chung với các yếu tố nguy cơ bao gồm hút thuốc lá, thiếu vitamin D, giảm BMI, kém vận động và sử dụng corticosteroid kéo dài. Điều trị và phòng ngừa loãng xương bao gồm điều chỉnh các yếu tố nguy cơ như cai thuốc lá, tập vận động, dùng corticosteroid thích hợp, phòng tránh và điều chỉnh suy dinh dưỡng.
Bệnh đái tháo đường cũng khá phổ biến trên bệnh nhân COPD với tỉ lệ khoảng 14% và làm tăng nguy cơ nhập viện và tử vong. Corticosteroid ảnh hưởng xấu đến kiểm soát đường huyết ở bệnh nhân đái tháo đường và làm thúc đẩy tăng đường huyết ở bệnh nhân có nguy cơ đái tháo đường.
COPD AND CO-MORBIDITIES
Abstract
COPD often coexists with other diseases (comorbidities) as cardiovascular diseases, lung cancer, weight loss, osteosporosis and diabetes…The prevalence of these diseases vary in different researches due to different ways of evaluating, diagnosing và researched population, but most of the results have shown that cardiovascular diseases are at the top of the list, in which chronic heart failure is the most common one.
Cardiovascular disease is a frequent and important comorbidity in COPD, related to poor prognosis, more symptoms and exercise intolerance, which should be screened, assessed and treated appropriately. In clinical practice, the effects of COPD drugs on cardiovascular diseases as well as the effects on CVD drugs on COPD should be clearly understood in order to have reasonable drug choices.
COPD patients have higher risks of lung cancer than people with normal lung function. Diagnosing and treating lung cancer in COPD patients are more difficult because the procedures are harder to carry out in moderate to severe COPD patients due to high risk of adverse outcomes.
Risk of osteo-sporosis in COPD patients increases as 14.8% compared to 10.8% in general population with risk factors including cigarette smoking, vitamin D deficiency, decreased BMI, sedentary lifestyle and long-term use of corticosteroids. Treating and preventing osteosporosis consist of modifying the risk factors such as quit smoking, exercise, appropriate use of corticosteroid, preventing and adjusting malnutrition.
Diabetes mellitus is also very common in COPD patients at about 14% and increases the hospital admission and mortality rates. Corticosteroids can worsen glycemic control in diabetes patients and precipitate hyperglycemia in patients who are at risk.
Đại cương
Bệnh phổi tắc nghẽn mạn tính (COPD) là bệnh lý mạn tính của đường hô hấp khá phổ biến hiện nay, được xem là một bệnh lý phức tạp và có thể gây tàn phế. Mặc dù mức độ tắc nghẽn luồng khí là một trong những điểm mấu chốt trong phân độ và đánh giá bệnh, những bệnh nhân ở cùng độ nặng thường có triệu chứng và nguy cơ tử vong khác nhau. Bên cạnh những tổn thương sinh lý bệnh tại phổi còn có một số ảnh hưởng đáng kể ngoài phổi và các ảnh hưởng ngoài phổi này có thể góp phần làm nặng thêm tình trạng của người bệnh. Hiện tượng viêm tại chỗ của khí đạo và nhu mô phổi vốn đã được biết rõ là một thành phần trong bệnh học COPD, tuy nhiên đã có nhiều bằng chứng cho thấy phản ứng viêm trong COPD là ở phạm vi toàn thân. Nhiều nghiên cứu chứng minh ở bệnh nhân COPD có hiện tương gia tăng các cytokin viêm không chỉ ở phổi mà ở mức độ toàn thể, bao gồm tumor necrosis factor alpha (TNF-α), interleukin 6 (IL6), interleukin 8 (IL8), C-reactive protein (CRP)…[25] Các tổn thương ngoài phổi được xem là có liên quan đến tình trạng viêm toàn thể của COPD, bao gồm bệnh tim mạch, ung thư phổi, sụt cân, loãng xương và đái tháo đường.
Nhiều nghiên cứu gần đây cũng cũng cho thấy bệnh nhân COPD thường có tăng khả năng xuất hiện các bệnh lý đồng mắc. Một nghiên cứu ở Hà lan thực hiện trên 290 bệnh nhân COPD có mức độ tắc nghẽn luồng khí từ nhẹ đến nặng cho thấy bệnh nhân ở nhóm COPD có khả năng mắc ít nhất 3 bệnh lý đồng mắc so với nhóm đối tượng có độ tuổi tương ứng nhưng không mắc COPD [23]. Tần suất của các bệnh lý đồng mắc sai biệt nhau giữa các nghiên cứu khác nhau, do các đánh giá và chẩn đoán các bệnh lý đồng mắc khác nhau và phân bố dân số nghiên cứu khác nhau. Tuy nhiên hầu hết các nghiên cứu đều cho thấy bệnh tim mạch là bệnh lý đồng mắc phổ biến nhất, trong đó đứng hàng đầu là suy tim mạn. Các bệnh lý đồng mắc thường gặp khác là cao huyết áp, rối loạn lipid máu, trầm cảm, đái tháo đường, bệnh cơ tim thiếu máu cục bộ, loãng xương, ung thư phổi và tai biến mạch máu não. Khi phân tích tần suất bệnh đồng mắc theo từng nhóm tuổi, tần suất bệnh đồng mắc ở nhóm 40 – 55 tuổi là 60,4% so sánh với 82,4% ở nhóm > 70 tuổi [23]. Tần suất bệnh đồng mắc không chỉ tăng theo tuổi mà còn tăng theo độ nặng của triệu chứng. Căn cứ vào thang điểm khó thở MRC 0 – 4, tần suất bệnh đồng mắc tương quan thuận với điểm khó thở MRC [3].
Tiên lượng chung của bệnh nhân COPD rất thay đổi và bị ảnh hưởng bởi nhiều yếu tố như tuổi, giới, BMI, bệnh lý đồng mắc, tình trạng sức khỏe chung và độ nặng của tổn thương tại phổi. Phân tích gộp của Briggs và cộng sự từ 12 thử nghiệm lâm sàng từ 8802 bệnh nhân COPD thực hiện bởi GSK cho thấy yếu tố tiên lượng tử vong quan trọng nhất ở nhóm bệnh nhân COPD vừa và nặng là bệnh lý tim mạch có sẵn với HR 2.5 (p<0,001); theo sau đó là tuổi (HR 1,05 p=0,001); BMI < 20kg/m2 (HR 2,08 p=0,002) và FEV1 (HR 0,98 p=0.006) [4]. Kết quả nghiên cứu TORCH cũng cho thấy nguyên nhân gây tử vong ở bệnh nhân COPD thường gặp là suy hô hấp (35%), bệnh tim mạch (26%) và ung thư phổi (12%) [13]. Như vậy, bệnh nhân COPD có khuynh hướng dễ mắc các bệnh đồng mắc khác nhau hoặc do hậu quả của tình trạng viêm toàn thể hoặc do chia sẻ cùng yếu tố nguy cơ hút thuốc lá. Các bệnh đồng mắc này có mối liên quan trực tiếp với độ nặng của bệnh và làm gia tăng bệnh suất, tử suất và việc sử dụng dịch vụ y tế của bệnh nhân COPD. Hầu hết các tài liệu hướng dẫn có uy tín như NICE, ATS/ERS và GOLD đều nhấn mạnh tầm quan trọng của việc đánh giá các bệnh đồng mắc ở bệnh nhân COPD [8,9,14,15]. Các tài liệu hướng dẫn này cũng nhấn mạnh sự cần thiết của việc lưu ý đến các bệnh đồng mắc khi điều trị bệnh nhân COPD. Tuy nhiên, các hướng dẫn chi tiết xử trí các bệnh đồng mắc còn chưa đầy đủ, chưa căn cứ trên các nghiên cứu có dữ liệu lớn và chưa bao gồm sự phức tạp khi bệnh nhân có cùng lúc nhiều bệnh đồng mắc khác nhau.
COPD và bệnh tim mạch
Bệnh tim mạch được xem là nhóm bệnh đồng mắc thường gặp nhất ở bệnh nhân COPD, trong đó phổ biến là suy tim mạn và bệnh mạch vành. Tần suất của hai bệnh này khoảng từ 10 – 30% và nguy cơ mắc bệnh suy tim mạn trên bệnh nhân COPD là 4,5 so sánh với nhóm chứng có độ tuổi tương ứng [7], có thể do tần suất các bệnh này thường tăng theo tuổi và có cùng yếu tố nguy cơ là hút thuốc lá.
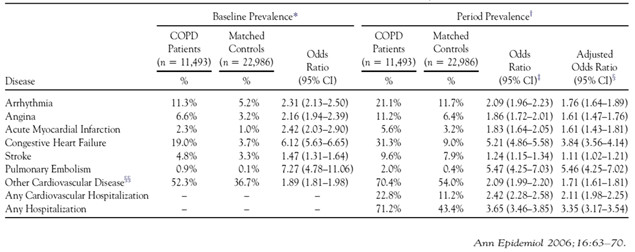
Bảng 1: Phân tích gộp về tần suất của bệnh tim mạch trên bệnh nhân COPD.
Các biến cố và tử vong do tim mạch thường gia tăng khi tình trạng tắc nghẽn luồng khí tiến triển. Ước tính sụt giảm mỗi 10% FEV1 sẽ làm gia tăng tử vong do tim mạch 28% và gia tăng biến cố bệnh mạch vành 20% [18].
Sự kết hợp đồng thời của bệnh phổi và bệnh tim mạch thường làm người bệnh có tiên lượng xấu hơn, nhiều triệu chứng hơn, kết cục lâm sàng xấu hơn và khả năng gắng sức kém hơn, vì vậy cần được chú ý phát hiện, đánh giá và có những biện pháp điều trị thích hợp. Mặc dù vậy, có khá ít bệnh nhân COPD có kèm suy tim mạn và bệnh mạch vành được điều trị thích hợp nhằm làm giảm nguy cơ và ngăn ngừa biến chứng. Một trong những lý do có thể giải thích khiến người ta e ngại trong những trường hợp này là vì thuốc điều trị chủ lực trong COPD là thuốc đồng vận β2 và thuốc điều trị chủ lực trong điều trị suy tim mạn và bệnh mạch vành là thuốc ức chế β có thể có tác dụng đối nghịch nhau và có những ảnh hưởng phức tạp trên các thụ thể β-adrenergic. Các thụ thể β-adrenergic là các thụ thể thuộc nhóm G protein, là đích đến đối với epinephrine và norepinephrine và bao gồm 3 subtype β1, β2 và β3. Hoạt động của thụ thể β1 làm tăng cung lượng tim bằng cách tăng nhịp tim, tăng co bóp cơ tim và tăng tốc độ dẫn truyền ở tim trong khi các thụ thể β2 có tác dụng làm giãn cơ trơn phế quản và tiểu phế quản, giãn cơ trơn đường tiêu hóa, bàng quang và tử cung. Thụ thể β1 nằm phần lớn tế bào cơ tim nhưng cũng có 10% nằm ở tuyến dưới niêm mạc và 30% ở thành phế nang; đồng thời cũng có khoảng 23% thụ thể β2 nằm ở tim. Ngoài ra, các thụ thể β3 chỉ nằm ở mô mỡ và tế bào cơ vân, chịu trách nhiệm trong quá trình ly giải mỡ và sinh nhiệt.
Ảnh hưởng của thuốc điều trị COPD trên bệnh tim mạch
Các thuốc giãn phế quản nhóm đồng vận β2 tác dụng ngắn và dài (albuterol, terbutaline, formoterol và salmeterol) được xem là thuốc điều trị chủ lực trong COPD. Thuốc đồng vận β2 thường có tính chọn lọc thấp và vì vậy các thụ thể β1 ở tim cũng có thể được hoạt hóa. Thuốc đồng vận β2 được xem là có thể có những ảnh hưởng xấu đến bệnh nhân có sẵn bệnh tim mạch qua các cơ chế sau:
- Kích thích các thụ thể β adrenergic trên tim gây rối loạn nhịp tim.
- Phản xạ qua cơ chế giao cảm gây giãn mạch ngoại biên.
- Thoái giáng các thụ thể β2 trên tim, làm nặng thêm rối loạn chức năng thất trái và suy tim.
- Giảm kali/ máu do đẩy kali vào tế bào.
Mặc dù được sử dụng bằng đường hít, các thuốc đồng vận β2 có thể dẫn đến nhịp tim nhanh và run và vì vậy, có thể ảnh hưởng xấu đến bệnh suy tim mạn. Một nghiên cứu hồi cứu trên 220 000 bệnh nhân hen và COPD cho thấy đồng vận β2 làm tăng nguy cơ nhập viện vì cơn nhịp nhanh trên thất và thiếu máu cơ tim [12]. Au và cộng sự cho thấy tăng nguy cơ nhập viện vì suy tim cũng như tăng tỉ lệ tử vong do mọi nguyên nhân ở những người rối loạn chức năng thất trái có sử dụng đồng vận β2 [2]. Tuy nhiên, một số nghiên cứu khác cho thấy đồng vận β2 an toàn và hiệu quả trên bệnh nhân COPD. Nghiên cứu TORCH bao gổm 6112 bệnh nhân COPD tiến hành trong 3 năm đã chứng minh các biến cố tim mạch không gia tăng trong nhóm salmeterol hoặc salmeterol kết hợp fluticasone [13]. Một nghiên cứu khác cho thấy salmeterol ở liều 50 mcg / 100 mcg hai lần mỗi ngày không làm thay đổi nhịp tim, xuất hiện nhịp thất sớm hay biểu hiện suy mạch vành trên ECG [22].
Tương tự, ảnh hưởng của thuốc kháng cholinergic (ipratropium và tiotropium) trên bệnh tim mạch có sẵn cũng có những kết quả khác nhau. Mặc dù phân tích gộp của Singh và cộng sự cho thấy thuốc kháng cholinergic đường hít làm gia tăng biến cố tim mạch trên bệnh nhân COPD [19], nghiên cứu UPLIFT bao gồm 5993 bệnh nhân COPD tiến hành trong 4 năm cho thấy giảm tỉ lệ tử vong liên quan đến tim mạch ở nhóm tiotropium với RR 0.78 95% CI [0,65- 0,94] [20].
Trong khi chờ đợi có thêm những số liệu đầy đủ hơn về ảnh hường của các nhóm SABA, LABA, SAMA và LAMA trên các bệnh lý tim mạch, cần thận trọng khi dùng liều cao ở những bệnh nhân COPD có kèm bệnh lý tim mạch có sẵn hoặc có nguy cơ cao mắc các bệnh lý tim mạch.
Ảnh hưởng của thuốc điều trị bệnh tim mạch trên COPD
· Thuốc ức chế β: Thuốc ức chế β thế hệ mới (carvedilol, metoprolol, bisiprolol) hiện nay được xem là một trong những thuốc điều trị hữu hiệu bệnh mạch vành và suy tim mạn. Thuốc ức chế β trước đây được xem là chống chỉ định sử dụng đối với các bệnh lý tắc nghẽn phế quản vì có thể gây ra những cơn co thắt phế quản thậm chí khi dùng liều rất thấp như thuốc nhỏ mắt điều trị glaucoma (timolol). Các thuốc ức chế β thế hệ mới có tính chọn lọc cao trên tim đã làm thay đổi quan niệm này. Một nghiên cứu phân tích gộp từ 19 nghiên cứu đánh giá hiệu quả của thuốc ức chế β chọn lọc trên bệnh nhân COPD cho thấy khởi đầu có giảm FEV1 nhẹ nhưng không làm tăng các triệu chứng hô hấp. Sau 4 tuần điều trị, không có sự khác biệt về FEV1, triệu chứng cũng như số lần dùng thuốc cắt cơn giữa nhóm sử dụng ức chế β chọn lọc so với giả dược [26]. Một nghiên cứu hồi cứu cho thấy thuốc ức chế β chọn lọc có thể làm giảm nguy cơ tử vong và tỉ lệ vào đợt cấp ở bệnh nhân COPD. Các số liệu khảo sát vẫn chưa đầy đủ vì vậy đối với các trường hợp COPD có kèm bệnh mạch vành hoặc suy tim mạn, có thể sử dụng các thuốc ức chế β thế hệ mới có tính chon lọc cao (carvedilol, metoprolol, bisiprolol), khởi đầu bằng liều thấp và cẩn trọng ở những bệnh nhân có mức độ tắc nghẽn nặng. Đối với bệnh nhân COPD có kèm cao huyết áp, thuốc ức chế β không phải là thuốc chọn lựa khởi đầu.
· Thuốc ức chế men chuyển: Một trong những tác dụng phụ thường gặp của thuốc ức chế men chuyển là ho với đặc điểm ho khan, thường không đàm và kéo dài, chiếm tỉ lệ 3 – 20%. Cơn ho này có thể che giấu hay lẫn lộn với cơn ho do co thắt hoặc cơn ho kéo dài gây ra cơn khó thở và thiếu oxy máu ở những bệnh nhân COPD nặng. Vì vậy, thuốc ức chế men chuyển không nên là thuốc chọn lựa khởi đầu nhưng không phải là chống chỉ định đối với bệnh nhân COPD có kèm bệnh tim mạch.
· Thuốc ức chế thu thể angiotensin: Thuốc ức chế thụ thể angiotensin không gây ho như nhóm thuốc ức chế men chuyển nhờ tránh được sự tích lũy kinin gây ho, vì vậy nên được thay thế các thuốc ức chế men chuyển trong điều trị bệnh nhân COPD có bệnh tim mạch đồng mắc, nhất là có kèm đái tháo đường và bệnh lý thận. Nhóm thuốc ức chế angiotensin còn có ưu điểm có thể làm giảm IL 6, một hóa chất trung gian gây viêm thường gặp trên bệnh nhân COPD qua đó có thể phần nào làm giảm tình trạng viêm toàn thể vốn chịu trách nhiệm cho sự phát triển của nhiều bệnh lý đồng mắc ở bệnh nhân COPD.
· Thuốc ức chế kênh calci: Các thuốc ức chế kênh calci, nhất là nhóm dihydropyridine khá an toàn khi sử dụng cho bệnh nhân COPD có kèm bệnh tim mạch. Ngoài ra, về mặt lý thuyết, thuốc ức chế kênh calci còn có tác dụng đối kháng với cơn co thắt cơ trơn khí phế quản và làm gia tăng hiệu quả giãn phế quản của thuốc đồng vận β2. Thuốc ức chế calci nên là thuốc chọn lựa khởi đầu cho bệnh nhân COPD có kèm tăng huyết áp.
· Thuốc lợi tiểu: Thuốc lợi tiểu là nhóm thuốc rất cần thiết trong điều trị tăng huyết áp và suy tim mạn, tuy nhiên cần lưu ý đến nguy cơ hạ kali máu. Ở bệnh nhân COPD cần phải thận trọng hơn vì thuốc đồng vận β2 thường đưa kali vào nội bào vì vậy làm giảm kali huyết tương đồng thời corticosteroid đường toàn thân có thể làm tăng nhẹ bài tiết kali qua nước tiểu. Đối với bệnh nhân COPD nặng, lưu ý nguy cơ kiềm chuyển hóa do hạ kali máu có thể làm nặng thêm tình trạng thiếu oxy máu. Nên sử dụng các thuốc lợi tiểu liều thấp hoặc phối hợp với các lợi tiểu giữ kali.
COPD và ung thư phổi
Ung thư phổi là bệnh ung thư phổ biến nhất trên thế giới với ước tính khoảng 1,6 triệu cas mới phát hiện hàng năm. Ung thư phổi cũng thường gặp ở bệnh nhân COPD do cùng chia sẻ yếu tố nguy cơ chung là hút thuốc lá. Ngoài ra, tắc nghẽn khí đạo cũng làm tăng nguy cơ ung thư phổi.
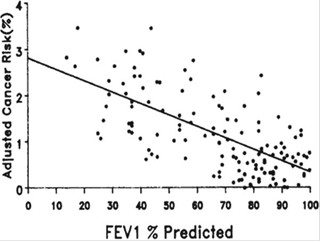
Hình 1: Tương quan giữa FEV1%P và nguy cơ ung thư phổi.
Nhiều nghiên cứu đã chứng minh bệnh nhân COPD có nguy cơ mắc ung thư phổi cao hơn so với người có chức năng hô hấp bình thường.Theo nghiên cứu của Tockman và cộng sự, tắc nghẽn khí đạo được xem là yếu tố nguy cơ ung thư phổi mạnh hơn cả số thuốc lá gói-năm: FEV1% dự đoán tương quan nghịch với nguy cơ ung thư phổi đã hiệu chỉnh (hình 1) và tỉ số OR của ung thư phổi ở nhóm tắc nghẽn khí đạo là 4,88.[21]. Nghiên cứu của Young và cộng sự cho thấy COPD chiếm tỉ lệ 50% trong số bệnh nhân ung thư phổi so sánh với 8% ở nhóm chứng với tuổi, giới và tiền sử hút thuốc lá tương ứng, tỉ số OR là 11,6 (p<0,0001) [27].
Chẩn đoán và điều trị ung thư phổi ở bệnh nhân COPD gặp ít nhiều khó khăn. Mặc dù nội soi phế quản khá an toàn với tỉ lệ biến chứng gây tử vong < 0.04%, kỹ thuật này thường không thực hiện được ở bệnh nhân COPD có mức độ tắc nghẽn vừa và nặng vì nguy cơ biến chứng cao. Dùng thuốc giãn phế quản trước khi nội soi không cải thiện được sự sụt giảm FEV1 đột ngột sau thủ thuật cũng như không ngăn ngừa được tình trạng giảm độ bão hòa oxy máu trong lúc soi. Sinh thiết hoặc chọc hút xuyên thành ngực dưới hướng dẫn CT thường được áp dụng cho các tổn thương ngoại biên, tuy nhiên cần lưu ý nguy cơ biến chứng tràn khí màng phổi, nhất là ở bệnh nhân COPD có khí phế thủng hoặc kén khí. Tế bào học trong đàm là kỹ thuật chẩn đoán có thể được lựa chọn khi các kỹ thuật xâm lấn gặp nhiều trở ngại.
Đối với bệnh nhân COPD kèm ung thư phổi ở giai đoạn có thể phẫu thuật được, cần lưu ý đánh giá tiền phẫu cẩn thận. Đo chức năng hô hấp và/hoặc DLCO tiền phẫu, ước tính chức năng hô hấp sau cắt phổi hoặc cắt thùy phổi và nghiệm pháp gắng sức tim – phổi cần được thực hiện đầy đủ để tránh nguy cơ biến chứng và tử vong sau mổ. Mặc dù chức năng hô hấp ở nhóm bệnh nhân COPD có khuynh hướng bảo tồn sau mổ so với nhóm chức năng hô hấp bình thường (có thể do hiệu quả cắt giảm thể tích phổi), tỉ lệ biến chứng sau mổ (rò khí, tràn khí màng phổi, viêm phổi, thở máy kéo dài…) ở nhóm COPD là 53% so với 19,3% ở nhóm không có COPD [17]. Tuy nhiên, tỉ lê sống 5 năm sau phẫu thuật điều tri ung thư phổi ở nhóm COPD và nhóm không COPD khác biệt không có ý nghĩa thống kê [11]. Các phương pháp điều trị không phẫu thuật như hóa trị, xạ trị, liệu pháp nhắm trúng đích, điều trị tại chỗ có thể được thực hiện ở những bệnh nhân không phẫu thuật được, tuy nhiên các số liệu thống kê nghiên cứu còn không đầy đủ. Điều trị giảm nhẹ cần được áp dụng cho các bệnh nhân COPD kèm ung thư phổi giai đoạn cuối.
COPD và bệnh loãng xương
Sự gia tăng tần suất loãng xương ở bệnh nhân COPD được mô tả ở nhiều nghiên cứu: tỉ lệ loãng xương ở nhóm COPD là 14,8% so với 10,8% trong dân số chung. Nữ giới luôn có tần suất loãng xương cao hơn nam giới với 18,4% so với 1,7% ở nam giới trong dân số chung, trong nhóm bệnh nhân COPD là 30,5% ở nữ so với 4,6% ở nam [6]. Mật độ xương có khuynh hướng giảm dần khi mức độ tắc nghẽn phế quản tăng dần: theo nghiên cứu của tỉ lệ loãng xương ở nhóm GOLD II là 26%, GOLD III là 49,9% và GOLD IV là 75%. Có khá nhiều yếu tố nguy cơ loãng xương ở bệnh nhân COPD bao gồm hút thuốc lá, thiếu vitamin D, giảm BMI, kém vận động và sử dụng corticosteroid kéo dài. Corticosteroid đường toàn thân từ lâu đã được công nhận là yếu tố nguy cơ của mềm xương (osteopenia) và loãng xương (osteoporosis) và nguy cơ này tăng phụ thuộc theo liều. Cơ chế giảm mật độ xương do corticosteroid bao gồm:
- Kích thích các tế bào hùy xương và ức chế hoạt động của các nguyên bào xương làm giảm tạo xương.
- Ức chế hoạt động của collagen type I làm ảnh hưởng sự hình thành khung xương (bone matrix).
- Ảnh hưởng quá trình chuyển hóa calci, mất calci qua cơ chế cường tuyến cận giáp thứ phát.
- Giảm hấp thu calcium và phosphat ở ruột đồng thời tăng thải calcium qua nước tiểu.
- Ảnh hưởng hormone thượng thận và tuyến yên làm giảm đồng hóa.
Corticosteroid đường hít bao gồm budesonide, beclomethasone, fluticasone và triamcinolol ở liều thấp thường ít hoặc không gây ra mềm xương hoặc loãng xương. Nhiều nghiên cứu thử nghiệm lâm sàng có nhóm chứng đã chứng minh corticosteroid dùng ở liều thông thường không làm gia tăng nguy cơ gãy xương hoặc giảm mật độ xương [10]. Tuy nhiên khi sử dụng liều cao kéo dài với fluticasone > 1000mcg/ngày, budesonide >800 mcg/ngày, beclomethasone >1000 mcg/ngày có thể ảnh hưởng đến sự mất xương.
Chẩn đoán mềm xương và loãng xương thường căn cứ vào kỹ thuật đo mật độ xương bằng máy DEXA (Dual energy Xray absorptiometry). Chỉ số T-score < -2,5 được chẩn đoán là loãng xương và -2,5< T-score< -1 được xem là mềm xương. Nên đo mật độ xương hàng năm để tầm soát loãng xương trên bệnh nhân COPD. Các xương thường bị gãy do loãng xương bao gồm xương cổ tay, xương chậu và cột sống. Cần chú ý chụp Xquang khi người bệnh có triệu chứng đau và cần quan sát kỹ phim Xquang để phát hiện nứt xương hoặc gãy xương kín đáo.
Điều trị và phòng ngừa loãng xương bao gồm điều chỉnh các yếu tố nguy cơ như cai thuốc lá, tập vận động, dùng corticosteroid thích hợp, phòng tránh và điều chỉnh suy dinh dưỡng. Điều trị dùng thuốc ở bệnh nhân COPD có kèm loãng xương cũng tương tự như phác đồ thông thường bao gồm bổ sung ít nhất 1000 mg calcium/ ngày và 800U vitamin D3 /ngày qua thức ăn hoặc thuốc, lưu ý nguy cơ tăng calci máu làm kém dung nạp đường tiêu hóa và sỏi thận. Calci cũng ảnh hưởng hấp thu và độ khả dụng sinh học của một số thuốc như quinolone, corticosteroid uống, biphosphonate. Các biphosphonate (etidronate, alendronate, risedronat) ảnh hưởng trên hoạt động của các tế bào hủy xương bằng cách ức chế hoạt động hoặc gây chết theo chương trình, nhờ vậy bảo tồn mật độ xương. Alendronate thường dùng 10 mg/ ngày hoặc resedronate 5mg/ ngày giúp giảm nguy cơ gãy cột sống 40% và gãy xương không phải cột sống ít nhất 20%. Estrogen thay thế thường được chỉ định ở phụ nữ mãn kinh. Calcitonin dùng qua đường xịt mũi giá thành cao nhưng có hiệu quả giảm đau hữu hiệu ở bệnh nhân loãng xương có gãy cột sống.
COPD và đái tháo đường
Bệnh đái tháo đường là một trong những bệnh đồng mắc khá phổ biến trên bệnh nhân COPD với tỉ lệ khoảng 14% [1] kèm theo với sự gia tăng nguy cơ nhập viện và tử vong.
Hai loại thuốc chủ yếu dùng trong điều trị COPD là thuốc đồng vận β2 và corticosteroid đều có ảnh hưởng đến chuyển hóa đường. Đồng vận β2 làm tăng ly giải đường còn corticosteroid làm tăng đường huyết thông qua việc kích thích tạo đường ở gan và giảm sử dụng đường ở ngoại biên, tăng thoái giáng protein và lipid dẫn đến gia tăng tân tạo đường. Corticosteroid ảnh hưởng xấu đến kiểm soát đường huyết ở bệnh nhân đái tháo đường và làm thúc đẩy tăng đường huyết ở bệnh nhân có nguy cơ đái tháo đường.
Chưa có những số liệu đầy đủ về ảnh hưởng của corticosteroid đường hít đối với việc kiểm soát đường huyết ở bệnh nhân đái tháo đường type II. Đối với corticosteroid đường toàn thân sử dụng trong đợt cấp COPD, mặc dù thuốc này giúp cải thiện chức năng hô hấp, rút ngắn thời gian nằm viện và giảm tỉ lệ thất bại điều trị nhưng kèm theo lại làm tăng nguy cơ tăng đường huyết với OR: 4.95; 95% CI [ 2.47–9.91] [24] . Việc kiểm soát mức đường huyết ở bệnh nhân COPD có kèm đái tháo đường nhập viện vì đợt cấp đôi khi khá khó khăn vì khó dự đoán được mức tăng đường huyết do corticosteroid. Lý tưởng nên giữ đường huyết ổn định không dao động quá mức theo những thời điểm sử dụng corticosteroid. Trên thực tế nên giữ đường huyết ở mức 120 – 140 mg/dl trong giai đoạn này để tránh các biến cố do tăng ceton/ máu hoặc tăng áp lực thẩm thấu đồng thời giảm nguy cơ hạ đường huyết do thuốc. Sử dụng thuốc hoặc điều chỉnh thuốc hạ đường huyết trong giai đoạn cấp tính này nên dùng nhóm sulfonylurea để có hiệu quả điều trị sớm thay vì dùng nhóm metformin hay thiazolidinedione chỉ đạt mức ổn định sau vài ngày. Ngoài ra, đối với những trường hợp bệnh nặng, nên ngưng metformin ở những cas có suy thận và ngưng thiazolidinedione ở bệnh nhân suy tim hoặc suy gan. Nếu có dùng thuốc để điều chỉnh tăng đường huyết do corticosteroid, khi giảm liều corticosteroid cũng phải đồng thời giảm liều thuốc điều trị đái tháo đường để tránh nguy cơ hạ đường huyết.
KẾT LUẬN
COPD hiện nay là một trong những bệnh có bệnh suất và tử suất rất cao và có khuynh hướng tiếp tục tăng cao trong những thập niên sắp tới. Các bệnh đồng mắc thường gặp trong COPD do hậu quả của tình trạng viêm toàn thể và chịu trách nhiệm một phần không nhỏ bệnh suất và tử suất của bệnh. Tầm soát và nhận biết sớm, lượng giá và có biện pháp xử trí thích hợp đối với các bệnh đồng mắc, cân nhắc sự tương tác giữa ảnh hưởng của thuốc và các biểu hiện bệnh lý khác nhau sẽ góp phần làm cải thiện kết cục lâm sàng của bệnh COPD.
TS BS Đỗ Thị Tường Oanh
TÀI LIỆU THAM KHẢO
1. Antonelli Incalzi R, Fuso L, De Rosa M, Forastiere F, Rapiti E, Nardecchia B, et al. Co-morbidity contributes to predict mortality of patients with chronic obstructive pulmonary disease. Eur Respir J. 1997;10(12):2794–800.
2. Au DH, Udris EM, Fan VS, Curtis JR, McDonell MB, Fihn SD. Risk of mortality and heart failure exacerbations associated with inhaled beta-adrenoceptor agonists among patients with known left ventricular systolic dysfunction. Chest. 2003;123(6):1964–9.
3. Barr RG, Celli BR, Mannino DM, et al. Comorbidities, patient knowledge, and disease man-agement in a national sample of patients with COPD. Am J Med. 2009;122(4):348–55.
4. Briggs A, Spencer M, Wang H, Mannino D, Sin DD. Development and validation of a prognostic index for health outcomes in chronic obstructive disease. Arch Intern Med 2008; 168 (1): 71-9.
5. Calverley PM, Anderson JA, Celli B, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med. 2007;356:775-789.
6. Cazzola M, Bettoncelli G, Sessa E, Cricelli C, Biscione G. Prevalence of comorbidities in patients with chronic obstructive pulmonary disease. Respiration. 2010;80(2):112–9.
7. Curkendall SM, DeLuise C, Jones JK, Lanes S, Stang MR, Goehring Jr E, et al. Cardiovascular disease in patients with chronic obstructive pulmonary disease, Saskatchewan Canada cardiovascular disease in COPD patients. Ann Epidemiol. 2006;16(1):63–70.
8. Fabri L, Boyd CM, Boschetto P, et al. How to deal with multiple comorbidities in guideline development: an official ATS/ERS Workshop Report. Manuscript submitted for publication, 2010.
9. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2017. Available from: http://www.goldcopd.org.
10. Langhammer A, Forsmo S, Syversen U. Long-term therapy in COPD: any evidence of adverse effect on bone? Int J COPD. 2009;4:365–80.
11. López-Encuentra A, Astudillo J, Cerezal J, et al. Prognostic value of chronic obstructive pulmonary disease in 2994 cases of lung cancer. Eur J Cardiothorac Surg. 2005;27:8–13.
12. Macie C, Wooldrage K, Manfreda J, Anthonisen N. Cardiovascular morbidity and the use of inhaled bronchodilators. Int J Chron Obstruct Pulmon Dis. 2008;3(1):163–9.
13. McGarvey LP, John M, Anderson JA, Zvarich M, Wise RA. Ascertainment of cause-specific mortality in COPD: operations of the TORCH Clinical Endpoint Committee. Thorax 2007 ; 62 (5): 411-5.
14. National Institut for Health and Clinical Excellence. Management of chronic obstructive pulmonary disease in adults in primary and secondary care. NICE clinical guideline 101. Developed by the National Collaborating Centre for Acute and Chronoc Conditions. http://guidance.nice.org.uk/CG101
15. Rabe KF, Hurd S, Anzueto A, et al. Global strategy for the diagnosis, management and prevention of chronic obstructive disease: GOLD executive summary. Am J Respir Crit Care Med. 2007; 176(6): 532-55.
16. Salpeter S, Ormiston T, Salpeter E. Cardioselective beta-blockers for chronic obstructive pul-monary disease. Cochrane Database Syst Rev 2005;(4):CD003566.
17. Sekine Y, Behnia M, Fujisawa T. Impact of COPD on pulmonary complications and on long-term survival of patients undergoing surgery for NSCLC. Lung Cancer. 2002;37:95–101.
18. Sin DD, Man SF. Chronic obstructive pulmonary disease as a risk factor for cardiovascular morbidity and mortality. Proc Am Thorac Soc 2005; 2:8
19. Singh S, Loke YK, Furberg CD. Inhaled anticholinergics and risk of major adverse cardiovas-cular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA. 2008;300(12):1439–50.
20. Tashkin DP, Celli B, Senn S, et al. UPLIFT: A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med. 2008;359:1543-1554.
21. Tockman MS, Anthonisen NR, Wright E, et al. Airways obstruction and the risk for lung cancer. Ann Intern Med. 1987;106:512–8.
22. Transfa CM, Pelaia G, Grembiale RD, et al. Shorterm cardiovascular effects of salmeterol. Chest 1998; 113: 1272 – 6.
23. Van Manen JG, Bindels PJ, IJzermans CJ, van der Zee JS, Bottema BJ, Schade E. Prevalence of comorbidity in patients with a chronic airway obstruction and controls over the age of 40. J Clin Epidemiol. 2001;54(3):287–93.
24. Walters JA, Gibson PG, Wood-Baker R, Hannay M, Walters EH. Systemic corticosteroids for acute exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2009;(1):CD001288.
25. Pinto-Plata VM, Livnat G, Girish M, Cabral H, Masdin P, Linacre P, et al. Systemic cytokines, clinical and physiological changes in patients hospitalized for exacerbation of COPD. Chest. 2007;131(1):37–43.
26. Salpeter S, Ormiston T, Salpeter E. Cardioselective beta-blockers for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2005;(4):CD003566.
27. Young RP, Hopkins RJ, Christmas T, et al. COPD prevalence is increased in lung cancer, independent of age, sex, and smoking history. Eur Respir J. 2009;34:380–6.