- Chi tiết
-
Được đăng: 10 Tháng 6 2021
Tóm tắt:
Trong những năm gần đây, người ta càng ngày càng chú ý đến vai trò của các đường thở nhỏ trong các bệnh đường hô hấp và vai trò của đường thở nhỏ trong sinh bệnh học COPD và hen. Mặc dù là vị trí rất khó tiếp cận để chẩn đoán, đánh giá nhưng cũng đã có nhiều bằng chứng rõ ràng về vai trò của bệnh lý đường thở nhỏ trong COPD và hen và đặc biệt là tổn thương đường thở nhỏ gắn liền với các đặc điểm bệnh học, lâm sàng riêng biệt. Điều này cho phép hướng tới việc tiếp cận điều trị COPD và hen hiệu quả hơn và có thể sớm hơn.
Abstract: Small airway disease in COPD and asthma
In recent years, increasing attention has been paid to the role of the small airways in respiratory diseases and the role of the small airways in the pathogenesis of COPD and asthma. Although it is a very difficult to approach for diagnosis and evaluation, there is also a lot of clear evidence about the role of small airway disease in COPD and asthma and especially small airway lesions associated with distinct clinical and pathological features. This allows towards more effective and possibly earlier to treat COPD and asthma.
ĐẶT VẤN ĐỀ
Đường thở người từ khí quản phân chia theo kiểu tách đôi với 23 lần phân chia cho tới ống phế nang (alveolar duct). Đường thở nhỏ được định nghĩa là đường thở có đường kính nội lòng ≤2mm ở người lớn, bắt đầu ở lần phân chia thứ 8 của cây phế quản trở xuống. Từ vị trí này, thành phế quản không còn cấu trúc sụn nên còn được gọi là tiểu phế quản màng (membranous bronchiole). Các nghiên cứu ban đầu tìm hiểu sinh lý đường thở trên phổi đã lấy ra khỏi cơ thể trong tình trạng xẹp cho rằng tổng diện tích cắt ngang khi phân chia phế quản không tăng lên do vậy trở kháng (resistance) đường thở sẽ tăng lên theo chiều phân chia phế quản, ít nhất là gấp đôi so với trước phân chia [1]. Đến năm 1965, Malcolm Green là người đầu tiên chứng minh ngược lại rằng trở kháng đường thở ngoại vi chỉ chiếm <10% tổng trở kháng đường thở [2]. Luận điểm này được giải thích bằng việc xác định tổng diện tích cắt ngang đường thở nhỏ lớn hơn nhiều so với đường dẫn khí phía trên. Từ phế quản thế hệ thứ 5-6, phế quản phân chia theo kiểu bán phân đôi (semi-dichotomous) nên tổng diện tích cắt ngang phế quản sau phân chia tăng theo hàm mũ so với thế hệ trước. Sau đó, đo trở kháng đường thở bằng kỹ thuật đặt catheter ngược dòng (retrograde catheter), Macklem và cs xác nhận luận điểm của Malcolm Green và chứng minh rằng đường thở nhỏ cung cấp rất ít trở kháng trong phổi [3]. Và thuật ngữ đường thở nhỏ lần đầu được Hogg và cs giới thiệu trong một bài báo năm 1968 [4]. Do tổng diện tích cắt ngang rộng hơn nên với cùng lưu lượng (flow) tốc độ di chuyển theo hướng thẳng (linear velocity) của dòng khí sẽ giảm đi nhiều ở phế quản nhỏ so với phế quản lớn. Ở khu vực này dòng khí chuyển động theo kiểu lớp (laminar flow) thay vì chuyển động theo kiểu xoắn (turbulent flow) như ở đường thở lớn, điều này tạo điều kiện thuận lợi cho trao đổi khí ở khu vực phế nang [5]. Tuy nhiên, cũng do đặc điểm động học này, các hạt bụi độc hại hay dị nguyên theo khí thở vào tới đây có trọng lượng cao hơn so với khí thở sẽ dễ dàng lắng đọng và có thể hình thành nên phản ứng viêm từ rất sớm ở khu vực này [6]. Do không có sụn trong thành, tính định hình của phế quản nhỏ phụ thuộc vào lực kéo ly tâm của cấu trúc mô phổi quanh phế quản, trương lực cơ trơn và sức căng bề mặt (surface tension) của lớp dịch lót (liquid lining) thấp. Hay nói một cách khác, các thay đổi bệnh lý của các thành phần trên rất dễ làm cho lòng đường thở nhỏ thu hẹp, xẹp lại và đây là cơ chế chính của hiện tượng khí cạm thì thở ra [7]. Các nghiên cứu về sau đã chỉ ra rằng trở kháng của các đường dẫn khí nhỏ ảnh hưởng rất ít đến các đặc tính cơ học của phổi vì có sự hiện diện của thông khí bàng hệ [8]. Chỉ khi đường thở nhỏ tắc nghẽn tới 75% mới có thể phát hiện được bằng các đánh giá chức năng thường quy [9]. Hiện tượng cho phép thông khí bù trừ vào khu vực không tắc nghẽn theo kiểu bàng hệ, tạo ra phân bố khí không đồng đều trong phổi [10], điều mà chúng ta có thể thấy rõ trên CT ngực trong các bệnh lý đường thở nhỏ bằng hình ảnh đậm độ phổi không đồng nhất (mosaic pattern of attenuation).
Bệnh lý đường thở nhỏ (small airway diseases, SAD) có mặt trong nhiều bệnh lý phổi-phế quản [9] và có thể gọi là hội chứng [11]. Sự liên quan của SAD trong COPD và hen đã được tranh luận trong một thời gian dài tuy nhiên chúng ta còn chưa có được một định nghĩa thực sự [12] và còn thiếu tiêu chuẩn vàng [13,14] mặc dù đã có nhiều biomarker, thông số chức năng và hình ảnh được chấp nhận rộng rãi trong đánh giá đường thở nhỏ [12]. Trong những năm gần đây, SAD đang ngày càng được chú ý về vai trò trong các bệnh đường hô hấp nói chung và trong COPD, hen. Tuy nhiên, cũng có thể nói tiếp cận nghiên cứu đường thở nhỏ không dễ dàng nên các thông tin hầu hết đến từ các bài báo, các nghiên cứu bệnh lý [15-17] hơn là các nghiên cứu lâm sàng. Bài viết tổng quan này nhằm điểm lại các nội dung y văn đề cập tới SAD trong COPD và hen.
BỆNH LÝ ĐƯỜNG THỞ NHỎ TRONG COPD
Trong COPD, tình trạng viêm mạn tính xảy ra trên cả đường thở lớn và đường thở nhỏ nhưng tập trung chủ yếu ở đường thở nhỏ, nhu mô phổi [18] và bệnh đường thở nhỏ đang được xem là hình ảnh bệnh học chính trong COPD [19]. Tổn thương trên đường thở nhỏ có sớm, trước khi có khí phế thũng [17,19,20]. Phân tích đặc điểm viêm trong COPD, Battaglia S và cs (2007) [21] nhận thấy có sự khác nhau trong phân bố tế bào trên toàn bộ đường thở. Số lượng bạch cầu đa nhân trung tính (BCĐNTT) và đại thực bào (ĐTB) có nhiều hơn ở khu vực đường thở nhỏ so với đường thở lớn. Trong một nghiên cứu khác, Hogg JC và cs (năm 2004) [22] ghi nhận có mối tương quan giữa số lượng tế bào BCĐNTT, ĐTB, các tế bào lympho T, B và sự xuất hiện của các nang lympho (lymphoid follicles) dưới niêm mạc đường thở nhỏ với mức độ nặng của tình trạng tắc nghẽn. Trên đường thở nhỏ, số lượng bạch cầu lympho T CD8+ tương quan nghịch với chức năng hô hấp đánh giá bằng FEV1 [23]. Bên cạnh hiện tượng gia tăng tế bào viêm, các biến đổi cấu trúc làm dầy thành phế quản như dị sản tăng số lượng tế bào chế tiết hình chén (goblet cell), tăng tiết dịch nhầy, xơ hóa quanh thành phế quản, phì đại cơ trơn cũng đã được ghi nhận trên đường thở nhỏ [5,24-26]. Trong một nghiên cứu hình ảnh đường thở nhỏ trên MDCT- microCT và mô học Naoya Tanabe và cs (năm 2018) [27] nhận thấy sự gia tăng thâm nhập tế bào lympho B trong thành có liên quan tới hiện tượng phá hủy cấu trúc phế nang quanh thành các tiểu phế quản tận. Nhận xét này cho chúng ta một sự liên hệ với đáp ứng miễn dịch thông qua lympho B, cơ chế đáp ứng miễn dịch thu được với cấu trúc phổi bị phá hủy (damage-associated molecular patterns, DAMPs) trong COPD. Hiện tượng khí cạm xảy ra sớm trong COPD. Bằng phương pháp lập bản đồ thông số phản ứng (parametric response map, MPR) trên hình ảnh CT scan phổi so sánh giữa thì thở vào và thì thở ra Miranda Kirby và cs nhận thấy hiện tượng khí cạm (MPRgasTrap) tăng sớm ngay từ nhóm nguy cơ COPD, GOLD I và GOLD II so với nhóm chứng không hút thuốc lá [28]. Như vậy, có cơ sở để tin rằng trong COPD, đường thở nhỏ là vị trí chính, quan trọng của tình trạng viêm, tạo khí cạm và có liên quan tới suy giảm chức năng hô hấp [29-31]. Khi hình thành khí phế thũng, sự phá hủy cấu trúc phế nang quanh thành phế quản là cơ chế tạo ra xẹp đường thở nhỏ. Phân tích hình ảnh đường thở nhỏ bằng CT scan đa dãy ở tất cả các giai đoạn trong COPD cho thấy sự thu hẹp và biến mất của các đường thở nhỏ có trước khi xuất hiện khí phế thũng, thậm trí xảy ra rất sớm. Nghiên cứu của McDonough JE [32] cho thấy đường thở nhỏ (2-2,5mm) giảm số lượng có ý nghĩa so với nhóm chứng ngay từ GOLD I và giảm nặng nhất là ở GOLD IV [32]. Đây là các cơ chế giải thích tình trạng tắc nghẽn đường thở ngoại vi trong COPD và đã được nhiều tác giả đồng thuận [32,33,34]. Với tiêu đề: “Khí phế thũng: Bệnh đường thở nhỏ hay bệnh nhu mô phổi” Wayne Mitzner, trên cơ sở phát hiện của McDonough JE và cs về hiện tượng thu nhỏ và biến mất của đường thở nhỏ trên bệnh nhân khí phế thũng [35], đã đưa ra hai giả thuyết về cơ chế hình thành khí phế thũng mà sinh bệnh bắt đầu từ đường thở nhỏ. Cơ chế phế nang- phế quản: viêm làn tràn từ phế quản nhỏ xuống phế nang làm đứt gãy các cấu trúc kết nối phế nang với đường thở nhỏ và làm cho đường thở nhỏ thu hẹp lại. Cơ chế phế quản-phế nang: viêm phù nề làm đứt gãy các sợi trun (elastic fibers) chạy dọc trong thành phế quản làm mất kết nối phế quản- phế nang làm cho các chùm nang (acinus) bị co cụm lại và phá hủy [36]. Bất luận cơ chế như thế nào, chúng ta cũng đều nhận thấy có sự kết hợp tổn thương phế quản nhỏ, phế nang mà trong đó vai trò viêm, phá hủy và tái tạo cấu trúc (remodeling) là rất quan
trọng (hình 1).
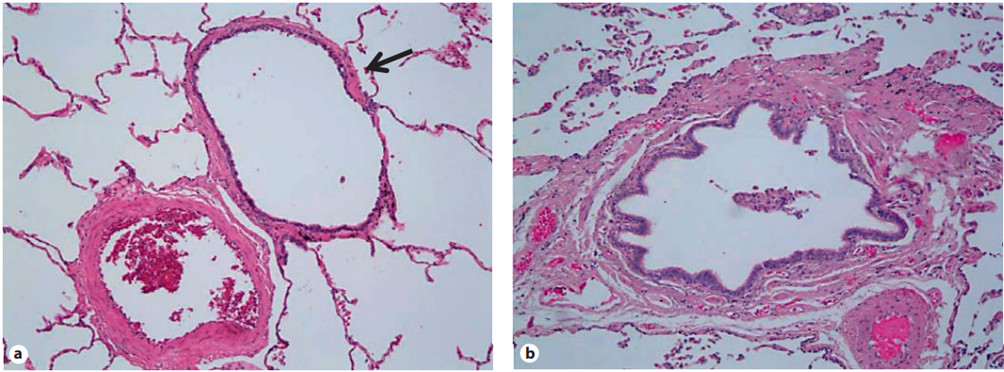
Hình 1. Hình thái đường thở nhỏ ở đối tượng không hút thuốc và ở một bệnh nhân COPD. a) Phế quản nhỏ ở người không hút thuốc (mũi tên) tiếp giáp với tiểu động mạch phổi. Lưu ý thành đường thở mỏng, lòng mạch mở rộng và các phế nang nguyên vẹn được gắn dọc theo chu vi của nó. b) Ở người hút thuốc bị COPD, lòng đường thở bị thu hẹp lại và chứa chất nhầy và các mảnh vụn tế bào. Thành đường dẫn khí là dày lên, nhất là với cơ trơn và xơ hóa đường thở. Phần lớn các phế nang bám dọc theo chu vi của phế quản bị phá vỡ (Simonetta Baraldo et al. Pathophysiology of the Small Airways in Chronic Obstructive Pulmonary Disease. Respiration 2012;84:89–97)
Bằng thông số R5-R20 của kỹ thuật đo dao động xung ký (Impulse oscillometry, IOS) cho thấy 74% bệnh nhân COPD có SAD. Mức độ nặng của SAD tương quan có ý nghĩa với điểm CAT [37]. Đánh giá SAD liên quan giữa tổn thương đường thở nhỏ/khí phế thũng với đặc điểm viêm và chức năng phổi đã được một nghiên cứu thực hiện và cho thấy khí phế thũng và SAD kết hợp độc lập với tắc nghẽn lưu thông khí (lần lượt là β = − 0.34, p < 0.001 và β = − 0.56, p <0.001). Tuy nhiên các thông số hình ảnh đánh giá bằng tỷ lệ vùng giảm đậm độ (%LAA), tỷ lệ vùng giảm đậm độ trung bình giữa hai thì thở (E/I MLD) và diện tích mắt cắt đường thở nhỏ (Pi10) không cho thấy có liên quan với các đặc điểm viêm đánh giá bằng tế bào học và vi trùng học đàm [38]. Như vậy marker viêm và vi trùng học không góp ích nhiều trong đánh giá SAD. Tuy nhiên tổng quan y văn SAD, Andrew Higham và cs (năm 2019) [34] cho rằng đã hình thành từ sớm và tạo ra một dạng vòng xoắn tương tác bệnh lý trên đường thở nhỏ trong đó có vai trò của viêm và đáp ứng viêm, nhiễm trùng (colonization) và đợt cấp trong việc duy trì và làm tiến triển bệnh.
Bảng 1. Phương pháp đánh giá bệnh đường thở nhỏ
(Elisabetta Zinellu et al. Int. J. Mol. Sci. 2019, 20, 2617)
|
Phương pháp |
Thông số đánh giá |
Thuận lợi |
Không thuận lợi |
|
Spirometry |
FVC/SVC, FEV3, FEV6, FEF25-75, Raw |
Không xâm lấn Dễ thực hiện Có sẵn |
Kết quả không ổn định |
|
Phế thân ký (Body plethysmography) |
RV/TLC, DLCO, |
Không xâm lấn Dễ thực hiện |
Chưa có nhiều bằng chứng Không có sẵn |
|
Impulse oscillometry (IOS) |
R5–R20, X5, AX, Fres |
Không xâm lấn Dễ thực hiện |
Không có sẵn
|
|
Test rửa trôi nitơ một lần thở và nhiều lần thở |
Slope phase III, CV, CC, Sacin, Scond |
Không xâm lấn Độ nhậy tốt và kết quả ổn định |
Không có sẵn
|
|
Hình ảnh
|
Khí cạm, độ dầy thành phế quản, giảm thông khí vùng, thể tích phổi không thông khí |
Không xâm lấn
|
Phơi nhiễm phóng xạ, Giá thành cao
|
|
NO thở ra |
NO phế nang |
Không xâm lấn Độ nhậy tốt và kết quả ổn định
|
Không đánh giá trực tiếp Cần tính toán và suy diễn |
|
Đàm kích thích |
Tế bào, marker viêm
|
Không xâm lấn Đánh giá trực tiếp |
Tính ổn định thấp
|
|
Sinh thiết xuyên thành |
Tế bào |
Đánh giá trực tiếp |
Xâm lấn |
|
Rửa phế quản-phế nang |
Tế bào |
Đánh giá trực tiếp |
Xâm lấn
|
Phân tích đặc điểm lâm sàng và hiệu quả sử dụng thuốc dãn phế quản có thể gợi ý cơ chế hình thành triệu chứng lâm sàng và tắc nghẽn thông khí liên quan tới SAD trong COPD. Roberta Pisi và cs (năm 2015) [39] nhận thấy những bệnh nhân có tổn thương đường thở nhỏ (xác định bằng dao động xung ký) đi kèm với chức năng hô hấp xấu hơn, khí cạm nặng hơn là tình trạng sức khỏe kém hơn. Trên những bệnh nhân này, khi sử dụng salbutamol (400mcg) FVC cải thiện nhưng FEV1 không cải thiện. O’Donnell DE và cs (năm 2009) [40] điều trị cho những bệnh nhân có biểu hiện ưu thế tổn thương đường thở nhỏ bằng ipratropium bromide 500mg cải thiện không nhiều nhưng ổn định các thông số dung tích hít vào động (dynamic inspiratory capacity), thể tích lưu thông và khả năng gắng sức.
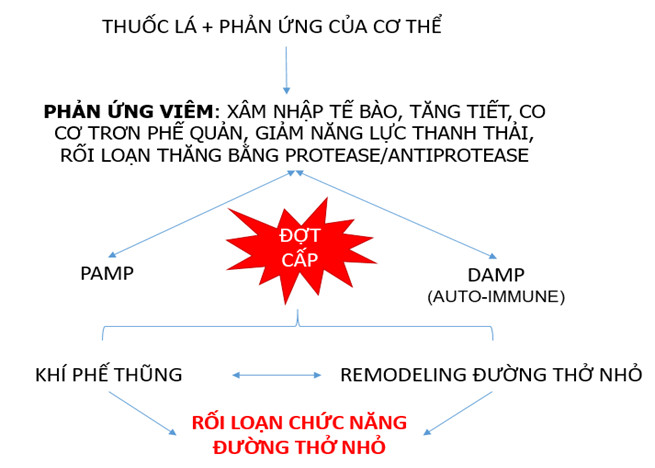
Hình 2. Sơ đồ sinh bệnh học đường thở nhỏ trong COPD
Qua phân tích đặc điểm bệnh học SAD cho thấy cần tập trung ưu tiên cho điều trị khu vực đường thở nhỏ trong COPD, ngay cả ở giai đoạn sớm. Các thuốc điều trị cần tiếp cận được cả ở đường thở lớn và đường thở nhỏ (thuốc toàn thân, thuốc xông-hít dạng hạt siêu nhỏ, extra-fine) thay vì sử dụng các thuốc chỉ tiếp cận được đường thở lớn [41].
BỆNH LÝ ĐƯỜNG THỞ NHỎ TRONG HEN
Giống như trong COPD hiện tượng viêm và tái tạo đường thở nhỏ xảy ra cả trong hen. Đường thở nhỏ cũng là vị trí gây tắc nghẽn chính trong hen [42]. Các dị nguyên có kích thước nhỏ (<5µm) có khả năng xâm nhập tới đường thở nhỏ và phế nang. Một nghiên cứu cho thấy khi kích thích bằng dị nguyên có đường kính nhỏ (<1,4 µm) phản ứng kích thích xảy ra mạnh hơn gấp 20 lần so với kích thích bằng dị nguyên có đường kính lớn (>10,4 µm) ở cả phase phản ứng sớm và phase phản ứng muộn [43]. Tuy nhiên, câu hỏi có mối liên quan giữa SAD và atopy hay không còn chưa có câu trả lời vì thiếu bằng chứng nghiên cứu thiết kế đoàn hệ [44]. Phân tích bệnh phẩm thu được từ sinh thiết xuyên thành bệnh nhân hen phụ thuộc corticosteroid (CRS) cho thấy có hiện tượng tập trung tế bào viêm, tế bào mast trên đường thở nhỏ nhiều hơn trên đường thở lớn [45,46]. Trên bệnh phẩm phổi sau mổ những trường hợp bệnh phổi không viêm, không hút thuốc lá, một nghiên cứu cho thấy tế bào mast phân bố không giống nhau ở các vị trí [47]. Điều này cho phép ngoại suy rằng sự tập trung tế bào mast có tính đặc hiệu cho từng vị trí. Trên bệnh nhân hen tử vong do cơn hen cấp, các phân tích phổi tử thi cho thấy có hiện tượng tăng tập trung bạch cầu ái toan (BCAT) [48] và tăng tế bào mast khử hạt ở khu vực đường thở nhỏ nhiều hơn ở đường thở lớn [42,48]. Sự phân bố của các tế bào viêm (BCAT, T CD45+, tế bào mast) trên các cấu trúc đường thở cũng khác nhau giữa đường thở lớn và đường thở nhỏ [49-51]. Trong một nghiên cứu, Pliss LB và cs ghi nhận tăng tổn thương đường thở nhỏ kết hợp với tăng phản ứng đường thở và tăng BCAT trong dịch rửa phế quản [52]. Cũng phân tích trên hen tử vong, các biến đổi cấu trúc trên đường thở nhỏ ở lớp ngoài, tầng dưới niêm mạc, lớp cơ trơn phế quản cũng nặng hơn so với nhóm chứng và so với COPD [53]. Một nghiên cứu khác phân tích bệnh phẩm phổi mổ vì ung thư trên bệnh nhân hen cho thấy tình trạng viêm đường thở nhỏ nặng hơn so với đường thở lớn [54]. Các biến đổi cấu trúc ngoại bào (extracellular matrix, ECM) xảy ra trên toàn bộ đường thở trên những trường hợp hen tử vong nhưng đặc biệt nặng ở lớp ngoài của thành phế quản nhỏ. Các biến đổi bao gồm tăng lắng đọng fibronectin, collagen I và collagen III cũng như tăng hiện diện một số metalloproteinase (MMP-1, MMP-2, và MMP-9). Những thay đổi trên làm mất gắn kết phế nang-phế quản nhỏ và làm xáo trộn hoạt động cơ học đường thở-nhu mô vùng trao đổi khí [55].
Các nghiên cứu về mối liên quan giữa hình ảnh bất thường đường thở nhỏ trên HRCT với lâm sàng và chức năng phổi cho thấy các biến đổi đậm độ phổi ở các thể tích phổi khác nhau có tương quan với mức độ nặng của bệnh [56]. Giảm đậm độ phổi cũng tương quan với tăng tỷ lệ TLC và RV / TLC và trở kháng đường thở đo bằng dao động xung ký cưỡng bức [57]. Đo mức độ giảm đậm độ phổi (% low attenuation area, %LAA) giữa hai thì thở vào và thở ra phản ánh mức độ khí cạm cho thấy trong hen SAD kết hợp mức độ tắc nghẽn, tăng phản ứng phế quản và lâm sàng nặng hơn [58]. Vậy liệu tổn thương đường thở nhỏ có phải là một dạng phenotype trong hen hay xảy ra trên tất cả bệnh nhân hen ?. In’t Veen JC và cs (năm 2000) ghi nhận trên hen ổn định cho thấy những trường hợp hen khó kiểm soát và nhiều đợt cấp có biểu hiện tăng thể tích và dung tích phổi đóng ngay cả khi đã sử dụng thuốc dãn phế quản [59]. Điều này cho thấy tăng thể tích phổi đóng ngay ở giai đoạn ổn định là nguy cơ của nhiều cơn cấp và là hậu quả của tổn thương đường thở nhỏ. Như vậy phenotype hen khó kiểm soát, hen nhiều đợt cấp có liên quan tới SAD. Kết hợp nghiên cứu SAD bằng IOS, chức năng phổi và lâm sàng, các nghiên cứu nhận định rằng có sự tương quan giữa tổn thương đường thở nhỏ với kiểm soát hen kém, ngay cả trên những người có FEV1>80% giá trị dự đoán [60-62]. Điều này gợi ý rằng có kiểu hình SAD trong hen, đó là các trường hợp hen có chức năng phổi bình thường khi đo bằng các phương pháp thường quy nhưng khó kiểm soát [63]. Tình huống này rất phổ biến trong hen trẻ em, nhóm bệnh nhân mặc dù hen nặng dai dẳng nhưng FEV1 vẫn bình thường [64,65]. SAD nặng có thể đại diện cho một kiểu hình riêng biệt của bệnh hen nặng tăng bạch cầu ái toan và có cải thiện đáng kể với trị liệu ức chế miễn dịch type 2 là kết luận của một nghiên cứu đoàn hệ trên
các trường hợp hen người lớn nặng tăng BCAT ở tất cả các mức độ nặng [66].
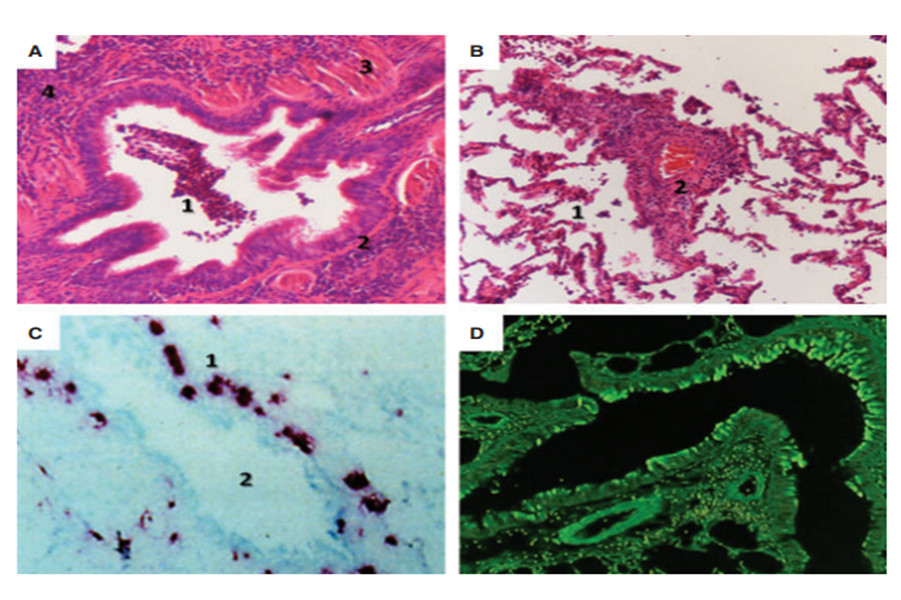
Hình 3. Bệnh lý ở đường thở nhỏ và phổi của bệnh nhân hen. (A) Đường thở nhỏ của một bệnh nhân hen nặng có biểu hiện: Đóng đường thở (1); xơ hóa dưới biểu mô (2); tăng khối lượng cơ trơn (3); Thâm nhiễm tế bào viêm (4). (B) Thâm nhiễm viêm trong nhu mô phổi (1) và mạch (2) của một bệnh nhân hen nặng. (C) Nhuộm miễn dịch cho thấy đa số protein cơ bản trên đường thở nhỏ (1) (mầu đỏ), cho thấy một số lượng lớn bạch cầu ái toan xung quanh đường thở nhỏ (2). (D) Nhuộm miễn dịch eotaxin trên đường thở nhỏ của bệnh nhân hen sử dụng kỹ thuật miễn dịch huỳnh quang. (Contoli et al. The small airways and distal lung compartment in asthma and COPD: a time for reappraisal M. Allergy 65, 2010, 141–151)
Bên cạnh những yếu tố làm giảm hiệu quả kiểm soát hen, càng ngày càng nhiều bằng chứng cho thấy tổn thương đường thở nhỏ góp vai trò quan trọng làm tăng triệu chứng, kiểm soát hen kém, tăng phản ứng phế quản, nhiều đợt cấp và gặp ở tất cả các mức độ hen [55,67-69]. Cũng có bằng chứng cho rằng SAD có kết hợp với hen về đêm, hen phụ thuộc corticosteroid, hen khó kiểm soát, hen hút thuốc lá [70]. SAD có thể gặp ở tất cả các mức độ nặng của hen. Một tổng quan hệ thống xác định tính phổ biến của SAD ở hen người lớn bằng nhiều kỹ thuật khác nhau bao gồm đo thông khí phổi, đo chức năng phổi bằng phế thân ký, rửa trôi nitơ, đo dao động xung, và chụp cắt lớp vi tính độ phân giải cao xác định SAD có ở 50-60% hen người lớn và ở tất cả các mức độ hen thậm trí cả khi không có tắc nghẽn đường thở lớn [71]. Ở hen trẻ em, SAD xác định bằng FeNO và rửa trôi nitơ cho thấy có mặt ở đa số các trường hợp [72]. Điều này cho thấy SAD là bệnh lý quan trọng trong hen và để tăng hiệu quả điều trị, tiếp cận chẩn đoán và điều trị SAD là rất quan trọng [73,74].
KẾT LUẬN
Đây có thể là bài viết tiếng Việt đầu tiên đề cập tới vấn đề đường thở nhỏ trong COPD và hen. Mặc dù không mới, nhưng SAD do khó tiếp cận chẩn đoán nên vẫn còn nhiều vấn đề rất cơ bản trong SAD còn chưa sáng tỏ. Trong đó các vấn đề quan trọng là: Có kiểu hình SAD trong COPD và hen hay không ?; Chẩn đoán SAD trong thực hành thường quy thế nào, có thể hay không định hướng bằng các tiêu chuẩn lâm sàng và marker thông thường ?; Tác dụng của điều trị sẽ như thế nào khi tiếp cận tới đường thở nhỏ ?. Sẽ còn cần nhiều nghiên cứu lâm sàng để làm sáng tỏ. Với các bằng chứng đã có để xác định cũng như để đánh giá SAD trong COPD và hen bài viết này trích lại tuyên ngôn của các tổ chức quốc tế như ARIA (Allergic rhinitis and its impact on asthma), GA2LEN (Global Allergy And Asthma European Network), WAO (World Allergy Organization) năm 2016 thay cho lời kết rằng đường thở nhỏ đóng một vai trò quan trọng trong cơ chế bệnh sinh của COPD và hen. Trong COPD và hen, các đường thở nhỏ có thể được xem là mục tiêu để đảm bảo kiểm soát bệnh và cho kết quả điều trị tốt hơn. Cũng tài liệu này đề nghị cần xem xét khả năng SAD bằng các phương tiện có thể khi đứng trước một trường hợp không kiểm soát tối đa được bệnh và/hoặc có các dấu hiệu chức năng hay sinh học gợi ý SAD. Đây là cơ sở để đánh giá hiệu quả điều trị và lựa chọn phương pháp trị liệu phù hợp [14].
TS.BS. NGUYỄN VĂN THÀNH
Cán bộ giảng Đại học Y-Dược Cần Thơ
Minh bạch:
- Tác giả bài viết không có mâu thuẫn lợi ích có liên quan tới bài viết cần thông báo.
- Tác giả đã sử dụng, vẽ và chú thích lại một số hình ảnh từ các bài viết của các tác giả khác (có chú thích trích dẫn).
TÀI LIỆU THAM KHẢO
|
1. |
Mead J. The lung’s “quiet zone. N Engl J Med 1970;282(23):1318- 1319 |
|
2. |
Green M. How big are the bronchioles? St. Thomas Hospital Gazette 1965:136-139. |
|
3. |
Macklem PT, Mead J. Resistance of central and peripheral airways measured by a retrograde catheter. J Appl Physiol 1967;22(3):395- 401 |
|
4. |
Hogg JC, Macklem PT, Thurlbeck WM. Site and nature of airway obstruction in chronic obstructive lung disease. N Engl J Med 1968;278(25):1355-1360. |
|
5. |
James C. Hogg, Peter D. Paré et al. The contribution of small airway obstruction to the pathogenesis of chronic obstructive pulmonary disease. Physiol Rev 97: 529 –552, 2017 |
|
6. |
James C. Hogg; John E. McDonough; Masaru Suzuki. Small Airway Obstruction in COPD New Insights Based on Micro-CT Imaging and MRI Imaging. Chest 2013; 143(5): 1436 – 1443 |
|
7. |
Peter T. Macklem. The Physiology of Small Airways. Am J Respir Crit Care Med Vol 157. pp S181–S183, 1998 |
|
8. |
Terry PB, Traystman RJ, Newball HH, Batra G, Menkes HA. Collateral ventilation in man. N Engl J Med 1978;298(1):10-15. |
|
9. |
Pierre-Regis Burgel, Anne Bergeron, Jacques de Blic et al. Small airways diseases, excluding asthma and COPD: an overview. Eur Respir Rev 2013; 22: 128, 131–147 |
|
10. |
Hogg W, Brunton J, Kryger M, Brown R, Macklem PT. Gas diffusion across collateral channels. J Appl Physiol 1972;33(5):568-575. |
|
11. |
Kenneth I. Berger. Small Airway Disease Syndromes Piercing the Quiet Zone. Ann Am Thorac Soc Vol 15, Supplement 1, pp S26–S29, Feb 2018 |
|
12. |
M. Contoli , J. Bousquet , L. M. Fabbri et al. The small airways and distal lung compartment in asthma and COPD: a time for reappraisal. Allergy 2010; 65: 141–151 |
|
13. |
K. Konstantinos Katsoulis, Konstantinos Kostikas, Theodore Kontakiotis. Techniques for assessing small airways function: Possible applications in asthma and COPD. Respiratory Medicine 119 (2016) e2-e9 |
|
14. |
Braido et al. Manifesto on small airway involvement and management in asthma and chronic obstructive pulmonary disease: an Interasma (Global Asthma Association - GAA) and World Allergy Organization (WAO) document endorsed by Allergic Rhinitis and its Impact on Asthma (ARIA) and Global Allergy and Asthma European Network (GA2 LEN). Asthma Research and Practice (2016) 2:12. |
|
15. |
Matteo Bonini, Omar S. Usmani. The role of the small airways in the pathophysiology of asthma and chronic obstructive pulmonary diseas. Ther Adv Respir Dis 2015, Vol. 9(6) 281–293 |
|
16. |
P.J. Sterk, E.H. Bel. Small airways, big challenge Eur Respir Rev 2011; 20: 119, 1–2 |
|
17. |
James A Stockley, Brendan G Cooper Robert, A Stockley et al. Small airways disease: time for a revisit?. International Journal of COPD 2017:12 2343–2353 |
|
18. |
Pierachille Santus, Dejan Radovanovic, Matteo Pecchiari et al. The Relevance of Targeting Treatment to Small Airways in Asthma and COPD. Respir Care 2020;65(9):1392–1412. |
|
19. |
Priyamvada S Chukowry, Daniella A Spittle, Alice M Turner. Small Airways Disease, Biomarkers and COPD: Where are We?. International Journal of Chronic Obstructive Pulmonary Disease 2021:16 351–365 |
|
20. |
Clémence Martin Justine Frija Pierre-Régis Burgel. Dysfunctional lung anatomy and small airways degeneration in COPD. International Journal of COPD 2013:8 7–13 |
|
21. |
Battaglia S, Mauad T, van Schadewijk AM, Vignola AM, Rabe KF, Bellia V, Sterk PJ, Hiemstra PS. Differential distribution of inflammatory cells in large and small airways in smokers. J Clin Pathol. 2007;60: 907–11. |
|
22. |
Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease. N Engl J Med. 2004;350: 2645–53. |
|
23. |
Saetta M, Di Stefano A, Turato G, Facchini FM, Corbino L, Mapp CE, Maestrelli P, Ciaccia A. Fabbri LM CD8+ T-lymphocytes in peripheral airways of smokers with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1998;157: 822–6. |
|
24. |
Saetta M, Turato G, Baraldo S, Zanin A, Braccioni F, Mapp CE, Maestrelli P, Cavallesco G, Papi A, Fabbri LM. Goblet cell hyperplasia and epithelial inflammation in peripheral airways of smokers with both symptoms of chronic bronchitis and chronic airflow limitation. Am J Respir Crit Care Med. 2000;161: 1016–21. |
|
25. |
Caramori G, Di Gregorio C, Carlstedt I, et al. Mucin expression in peripheral airways of patients with chronic obstructive pulmonary disease. Histopathology. 2004;45: 477–84 |
|
26. |
James C Hogg. Pathophysiology of airflow limitation in chronic obstructive pulmonary disease Lancet 2004; 364: 709–21 |
|
27. |
Naoya Tanabe, Dragoş M. Vasilescu, Miranda Kirby et al, Analysis of airway pathology in COPD using a combination of computed tomography, micro-computed tomography, and histology. Eur Respir J. 2018 February ; 51(2) |
|
28. |
Miranda Kirby, Youbing Yin, Juerg Tschirren et al. A Novel Method of Estimating Small Airway Disease Using Inspiratory-toExpiratory Computed Tomography. Respiration 2017;94:336–345 |
|
29. |
Hirano T, Matsunaga K, Sugiura H, Minakata Y, Koarai A, Akamatsu K, Ichikawa T, Furukawa K, Ichinose M. Relationship between alveolar nitric oxide concentration in exhaled air and small airway function in COPD. J Breath Res. 2013;7(4):046002. |
|
30. |
Shukla SD, Muller HK, Latham R, Sohal SS, Walters EH. Platelet-activating factor receptor (PAFr) is upregulated in small airways and alveoli of smokers and COPD patients. Respirology. 2016;21(3):504–10. |
|
31. |
Ostridge K, Williams N, Kim V, Bennett M, Harden S, Welch L, Bourne S, Coombs NA, Elkington PT, Staples KJ, Wilkinson TM. Relationship between pulmonary matrix metalloproteinases and quantitative CT markers of small airways disease and emphysema in COPD. Thorax. 2016;71(2):126–32 |
|
32. |
McDonough JE, Yuan R, Suzuki M et al. Small-Airway Obstruction and Emphysema in Chronic Obstructive Pulmonary Disease. N Engl J Med. 2011 October 27; 365(17): 1567–1575. |
|
33. |
John E. McDonough, Ren Yuan, Masaru Suzuki, et al. Small-Airway Obstruction and Emphysema in Chronic Obstructive Pulmonary Disease. n engl j med 365;17 nejm.org october 27, 2011 |
|
34. |
Andrew Higham, Anne Marie Quinn, José Eduardo D. Cançado, Dave Singh. The pathology of small airways disease in COPD: historical aspects and future directions. Respiratory Research (2019) 20:49 |
|
35. |
McDonough JE, Yuan R, Suzuki M, et al. The Relationship between Small Airway Obstruction and Emphysema in COPD. New England J Med. 2011 |
|
36. |
Wayne Mitzner. Emphysema: a disease of small airways or lung parenchyma? N Engl J Med. 2011 October 27; 365(17): 1637–1639. doi:10.1056/NEJMe1110635. |
|
37. |
Dave Singh. Small Airway Disease in Patients with Chronic Obstructive Pulmonary Disease. Tuberc Respir Dis 2017;80:317-324 |
|
38. |
Ostridge et al. Relationship of CT-quantified emphysema, small airways disease and bronchial wall dimensions with physiological, inflammatory and infective measures in COPD. Respiratory Research (2018) 19:31 |
|
39. |
Roberta Pisi, Marina Aiello, Andrea Zanini et al. Small airway dysfunction and flow and volume bronchodilator responsiveness in patients with chronic obstructive pulmonary disease. International Journal of COPD 2015:10 1191–1197 |
|
40. |
O’Donnell DE, Laveneziana P, Ora J, et al. Evaluation of acute bronchodilator reversibility in patients with symptoms of GOLD stage I COPD. Thorax 2009; 64: 216–223 |
|
41. |
P-R. Burgel, A. Bourdin, P. Chanez et al. Update on the roles of distal airways in COPD. Eur Respir Rev 2011; 20: 119, 7–22 |
|
42. |
P-R. Burgel, J. de Blic, P. Chanez, C. Delacourt et al Update on the roles of distal airways in asthma. Eur Respir Rev 2009; 18: 112, 80–95 |
|
43. |
Lieutier-Colas F, Purohit A, Meyer P, Fabries JF, Kopferschmitt MC, Dessanges JF, et al. Bronchial challenge tests in patients with asthma sensitized to cats: the importance of large particles in the immediate response. Am J Respir Crit Care Med 2003;167:1077-82. |
|
44. |
Postma DS, Brightling C, Baldi S, et al. Exploring the relevance and extent of small airways dysfunction in asthma (ATLANTIS): baseline data from a prospective cohort study. Lancet Respir Med 2019; 7: 402–16. |
|
45. |
Balzar S, Wenzel SE, Chu HW. Transbronchial biopsy as a tool to evaluate small airways in asthma. Eur Respir J. 2002;20: 254–9. |
|
46. |
Balzar S, Chu HW, Strand M, Wenzel S. Relationship of small airway chymase-positive mast cells and lung function in severe asthma. Am J Respir Crit Care Med. 2005;1(171): 431–9. |
|
47. |
Andersson CK, Mori M, Bjermer L, Löfdahl C-G, Erjefålt JS. Novel site-specific mast cell subpopulations in the human lung. Thorax. 2009;64: 297–305. |
|
48. |
Synek M, Beasley R, Frew AJ, et al. Cellular infiltration of the airways in asthma of varying severity. Am J Respir Crit Care Med 1996; 154: 224–230. |
|
49. |
Carroll NG, Mutavdzic S, James AL. Increased mast cells and neutrophils in submucosal mucous glands and mucus plugging in patients with asthma. Thorax. 2002; 57: 677–682. |
|
50. |
Carroll NG, Mutavdzic S, James AL. Distribution and degranulation of airway mast cells in normal and asthmatic subjects. Eur Respir J 2002; 19: 879–885. |
|
51. |
Haley KJ, Sunday ME, Wiggs BR, et al. Inflammatory cell distribution within and along asthmatic airways. Am J Respir Crit Care Med 1998; 158: 565–572. |
|
52. |
Pliss LB, Ingenito EP, Ingram RH Jr. Responsiveness, inflammation, and effects of deep breaths on obstruction in mild55555 asthma. J Appl Physiol 1989;66: 2298-304. |
|
53. |
Kuwano K, Bosken CH, Pare PD, et al. Small airways dimensions in asthma and in chronic obstructive pulmonary disease. Am Rev Respir Dis 1993; 148: 1220–122 |
|
54. |
Qutayba Hamid, Yunling Song, Thomas C. Kotsimbos. Inflammation of small airways in asthma . J Allergy Clin Immunol 1997;100:44-51 |
|
55. |
Qutayba Hamid. Pathogenesis of Small Airways in Asthma. Respiration 2012;84:4–11 |
|
56. |
Ueda T, Niimi A, Matsumoto H, et al. Role of small airways in asthma: investigation using high-resolution computed tomography. J Allergy Clin Immunol 2006; 118: 1019–1025 |
|
57. |
Jain N, Covar RA, Gleason MC, et al. Quantitative computed tomography detects peripheral airway disease in asthmatic children. Pediatr Pulmonol 2005; 40: 211–218. |
|
58. |
Tetsuya Ueda, Akio Niimi, Hisako Matsumoto et al. Role of small airways in asthma: Investigation using high-resolution computed tomography. J Allergy Clin Immunol 2006;118:1019-25. |
|
59. |
In ’t Veen JC, Beekman AJ, Bel EH, et al. Recurrent exacerbations in severe asthma are associated with enhanced airway closure during stable episodes. Am J Respir Crit Care Med 2000; 161: 1902–1906. |
|
60. |
Takeda T, Oga T, Niimi A, Matsumoto H, Ito I, Yamaguchi M, et al. Relationship between Small Airway Function and Health Status, Dyspnea and Disease Control in Asthma. Respiration. 2010;80:120–6. |
|
61. |
Pisi R, Tzani P, Aiello M, Martinelli E, Marangio E, Nicolini G, et al. Small airway dysfunction by impulse oscillometry in asthmatic patients with normal forced expiratory volume in the 1st second values. Allergy Asthma Proc. 2013;34(1):e14–20. |
|
63. |
Manoharan A, Anderson WJ, Lipworth J, Ibrahim I, Lipworth BJ. Small airway dysfunction is associated with poorer asthma control. Eur Respir J. 2014;44(5):1353–5. |
|
63. |
Cottini et al. Small airway dysfunction and bronchial asthma control : the state of the art. Asthma Research and Practice (2015) 1:13 |
|
64. |
Lipworth B, Manoharan A, Anderson W. Unlocking the quiet zone: the small airway asthma phenotype. Lancet Respir Med. 2014;2:497–506. |
|
65. |
Bacharier LB, Strunk RC, Mauger D, White D, Lemanske RF Jr, Sorkness CA, et al. Classifying asthma severity in children: mismatch between symptoms, medication use, and lung function. Am J Respir Crit Care Med. 2004;170(4):426–32. |
|
66. |
Mustafa Abdo , Henrik Watz , Vera Veith et al. Small airway dysfunction as predictor and marker for clinical response to biological therapy in severe eosinophilic asthma: a longitudinal observational study. Respir Res (2020) 21:278 |
|
67. |
Halwani R, Al-Muhsen S, Hamid Q. Airway remodeling in asthma. Curr Opin Pharmacol. 2010;10(3):236–45 |
|
68. |
Jarjour NN, Erzurum SC, Bleecker ER, Calhoun WJ, Castro M, Comhair SA, et al. Severe asthma: lessons learned from the National Heart, Lung, and Blood Institute Severe Asthma Research Program. Am J Respir Crit Care Med. 2012;185(4):356–62. |
|
69. |
Mauad T, Bel EH, Sterk PJ. Asthma therapy and airway remodeling. J Allergy Clin Immunol. 2007;120(5):997–1009. |
|
70. |
Contoli M, Kraft M, Hamid Q, Bousquet J, 64Rabe KF, Fabbri LM, et al. Do small airway abnormalities characterize asth65ma phenotypes? In search of proof. Clin Exp Allergy. 2012;42(8):1150–60.66 |
|
71. |
Usmani OS, Singh D, Spinola M, Bizzi A, Barnes PJ. The prevalence of small airways disease in adult asthma: a systematic literature review. Respir Med. 2016;116:19–27. |
|
72. |
Keen C, Olin AC, Wennergren G, Gustafsson P. Small airway function, exhaled NO and airway hyper-responsiveness in paediatric asthma. Respir Med. 2011;105(10):1476–84. |
|
73. |
Marcello Cottini, Carlo Lombardi, Claudio Micheletto. Small airway dysfunction and bronchial asthma control : the state of the art. Asthma Research and Practice (2015) 1:13 |
|
74. |
N. Scichilone, S. Battaglia, D. Olivieri, V. Bellia. The role of small airways in monitoring the response to asthma treatment: what is beyond FEV1 ?. Allergy 2009: 64: 1563–1569 |